Электролизная: Что такое электролизер, его принцип работы, конструкция и виды
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.


Что такое электролиз?
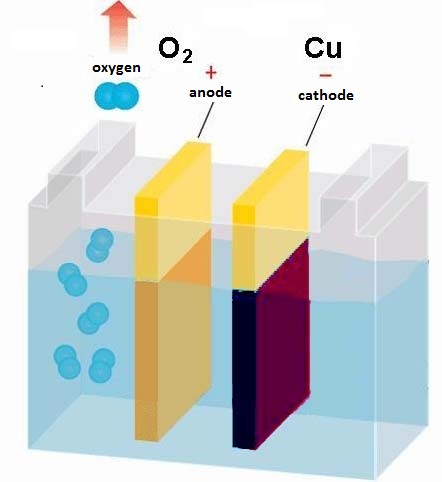
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.


Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:


k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.
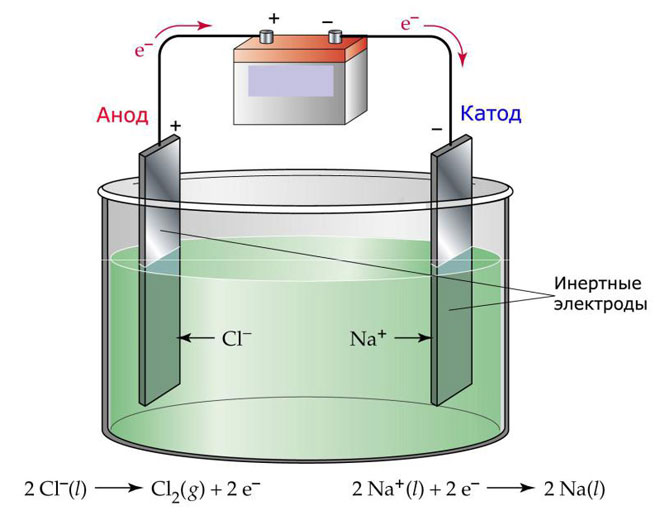

При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.


Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
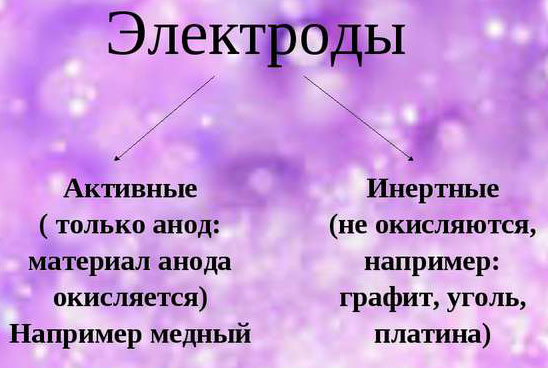

При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.


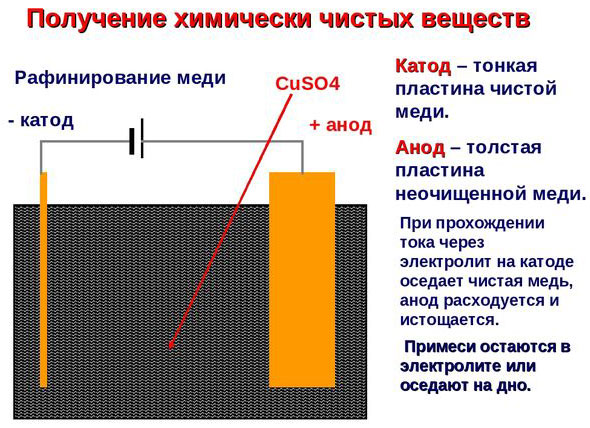
Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.

Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
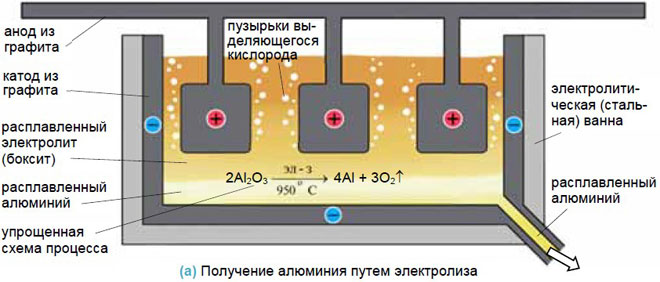

Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
электролизная — это… Что такое электролизная?
- электролизная
электролизная
(напр. на ТЭС, АЭС)
[А.С.Гольдберг. Англо-русский энергетический словарь. 2006 г.]Тематики
- энергетика в целом
Справочник технического переводчика. – Интент. 2009-2013.
- электролизер с ртутным катодом
- электролизная ванна
Смотреть что такое «электролизная» в других словарях:
электролизная ванна — электролитическая ванна Емкость с электролитом для проведения в ней электролиза, электролитич. рафинирования или гальванотехнич. процесса. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом Синонимы электролитическая ванна EN… … Справочник технического переводчика
Электролизная металлизация — Electroless plating Электролизная металлизация. (1) Процесс, в котором металлические ионы в разбавленном водном растворе осаждаются на детали посредством автокаталитического химического восстановления. (2) Отложение проводящего материала из… … Словарь металлургических терминов
электролизная ванна
— Смотри электролизная (электролитическая) ванна … Энциклопедический словарь по металлургииэлектролизная (электролитическая) ванна — [electrolyzer] емкость с электролитом для проведения в ней электролиза, электролитического рафинирования или гальванотехнического процесса. Смотри также: Ванна шлаковая ванна сварочная ванна ванна для термической обработки … Энциклопедический словарь по металлургии
электролизная очистка — Syn: электролизное очищение … Металлургический словарь терминов
Блочная электролизная установка — (БЭУ) комплектная установка по получению водорода, состоящая из нескольких электролизеров, сблокированных в один агрегат, и имеющая единую аппаратуру… Источник: Постановление Госгортехнадзора РФ от 06.06.2003 N 75 Об утверждении Правил… … Официальная терминология
Водородная (электролизная) установка — агрегатированная установка, совокупность нескольких аппаратов и устройств на базе электролизера, предназначенная для получения водорода и кислорода, а также отделения их друг от друга, электролита и влаги, для обеспечения систем регуляции… … Официальная терминология
Блочная электролизная установка (БЭУ) — комплектная установка по получению водорода, состоящая из нескольких электролизеров, сблокированных в один агрегат, и имеющая единую аппаратуру. Источник: ПБ 03 598 03: Правила безопасности при производстве водорода методом электролиза воды … Словарь-справочник терминов нормативно-технической документации
Водородная (электролизная) установка — агрегатированная установка, совокупность нескольких аппаратов и устройств на базе электролизера, предназначенная для получения водорода и кислорода, а также отделения их друг от друга, электролита и влаги, для обеспечения систем регуляции… … Словарь-справочник терминов нормативно-технической документации
ПБ 03-598-03: Правила безопасности при производстве водорода методом электролиза воды — Терминология ПБ 03 598 03: Правила безопасности при производстве водорода методом электролиза воды: «Допускается» данное решение применяется в виде исключения как вынужденное. Определения термина из разных документов: «Допускается» «Как правило»… … Словарь-справочник терминов нормативно-технической документации
ЭЛЕКТРО́ЛИЗНЫЙ, —ая, —ое. Прил. к электролиз. Электролизный цех. || Предназначенный, служащий для электролиза. Электролизная ванна. || Получаемый путем электролиза. Электролизная медь.
Источник (печатная версия):
Делаем Карту слов лучше вместе
 Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Вопрос: реформироваться — это что-то нейтральное, положительное или отрицательное?
Положительное
Отрицательное
Электролизер – это специальное устройство, которое предназначено для разделения компонентов соединения или раствора с помощью электрического тока. Данные приборы широко используются в промышленности, к примеру, для получения активных металлических компонентов из руды, очищения металлов, нанесения на изделия металлических покрытий. Для быта они используются редко, но также встречаются. В частности для домашнего использования предлагаются устройства, которые позволяют определить загрязненность воды или получить так называемую «живую» воду.
Основа работы устройства принцип электролиза, первооткрывателем которого считается известный зарубежный ученый Фарадей. Однако первый электролизер воды за 30 лет до Фарадея создал русский ученый по фамилии Петров. Он на практике доказал, что вода может обогащаться в катодном или анодном состоянии. Несмотря на эту несправедливость, его труды не пропали даром и послужили развитию технологий. На данный момент изобретены и с успехом используются многочисленные виды устройств, которые работают по принципу электролиза.
Что это
Электролизер работает благодаря внешнему источнику питания, который подает электрический ток. Упрощенно агрегат выполнен в виде корпуса, в который вмонтировано два или несколько электродов. Внутри корпуса находится электролит. При подаче электрического тока происходит разложение раствора на требуемые составляющие. Положительно заряженные ионы одного вещества направляются к отрицательно заряженному электроду и наоборот.
Основной характеристикой подобных агрегатов является производительность. То есть это количество раствора или вещества, которое установка может перерабатывать за определенный период времени. Данный параметр указывается в наименовании модели. Однако на него также могут влиять и иные показатели: сила тока, напряжение, вид электролита и так далее.
Виды и типы
По конструкции анода и расположению токопровода электролизер может быть трех видов, это агрегаты с:
- Прессованными обожженными анодами.
- Непрерывным самообжигающимся анодом, а также боковым токопроводом.
- Непрерывным самообжигающимся анодом, а также верхним токопроводом.
Электролизер, используемый для растворов, по конструктивным особенностям можно условно разделить на:
- Сухие.
- Проточные.
- Мембранные.
- Диафрагменные.
Устройство
Конструкции агрегатов могут быть различными, но все они работают на принципе электролиза.
Устройство в большинстве случаев состоит из следующих элементов:
- Электропроводящий корпус.
- Катод.
- Анод.
- Патрубки, предназначенные для ввода электролита, а также вывода веществ, полученных в ходе реакции.
Электроды выполняются герметичными. Обычно они представлены в виде цилиндров, которые сообщаются с внешней средой с помощью патрубков. Электроды изготавливаются из специальных токопроводящих материалов. На катоде осаждается металл или к нему направляют ионы отделенного газа (при расщеплении воды).
В цветной промышленности часто применяют специализированные агрегаты для электролиза. Это более сложные установки, которые имеют свои особенности. Так электролизер для выделения магния и хлора требует ванну, выполненную из стенок торцевого и продольного вида. Она обкладывается с помощью огнеупорных кирпичей и иных материалов, а также делится с помощью перегородки на отделение для электролиза и ячейку, в которой собираются конечные продукты.
Конструктивные особенности каждого вида подобного оборудования позволяют решать лишь конкретные задачи, которые связаны с обеспечением качества выделяющихся веществ, скоростью происходящей реакции, энергоемкостью установки и так далее.
Принцип действия
В электролизных устройствах электрический ток проводят лишь ионные соединения. Поэтому при опускании электродов в электролит и включении электрического тока, в нем начинает течь ионный ток. Положительные частицы в виде катионов направляются к катоду, к примеру, это водород и различные металлы. Анионы, то есть отрицательно заряженные ионы текут к аноду (кислород, хлор).
При подходе к аноду анионы лишаются своего заряда и становятся нейтральными частицами. В результате они оседают на электроде. У катода происходят похожие реакции: катионы забирают у электрода электроны, что приводит к их нейтрализации. В результате катионы оседают на электроде. К примеру, при расщеплении воды образуется водород, которые поднимается наверх в виде пузырьков. Чтобы собрать этот газ над катодом сооружаются специальные патрубки. Через них водород поступает в необходимую емкость, после чего его можно будет использовать по назначению.
Принцип действия в конструкциях разных устройств в целом схож, но в ряде случаев могут быть и свои особенности. Так в мембранных агрегатах используется твердый электролит в виде мембраны, которая имеет полимерную основу. Главная особенность подобных приборов кроется в двойном назначении мембраны. Эта прослойка может переносить протоны и ионы, в том числе разделять электроды и конечные продукты электролиза.
Диафрагменные устройства применяются в случаях, когда нельзя допустить диффузию конечных продуктов электролизного процесса. С этой целью применяют пористую диафрагму, которая выполнена из стекла, асбеста или керамики. В ряде случаев в качестве подобной диафрагмы могут применяться полимерные волокна либо стеклянная вата.
Применение
Электролизер широко применяется в различных отраслях промышленности. Но, несмотря на простую конструкцию, оно имеет различные варианты исполнения и функции. Данное оборудование применяется для:
- Добычи цветных металлов (магний, алюминий).
- Получения химических элементов (разложение воды на кислород и водород, получение хлора).
- Очистки сточных вод (обессоливание, обеззараживание, дезинфекция от ионов металлов).
- Обработки различных продуктов (деминерализация молока, посол мяса, электроактивация пищевых жидкостей, извлечение нитратов и нитритов из овощных продуктов, извлечения белка из водорослей, грибов и рыбных отходов).
В медицине установки используются в интенсивной терапии для детоксикации организма человека, то есть для создания растворов гипохлорита натрия высокой чистоты. Для этого используется устройство проточного вида с электродами из титана.
Электролизные и электродиализные установки нашли широкое применение для решения экологических проблем и опреснения воды. Но эти агрегаты в виду их недостатков используются редко: это сложность конструкции и их эксплуатации, необходимость трехфазного тока и требования периодической замены электродов из-за их растворения.
Подобные установки находят применение и в быту, к примеру, для получения «живой» воды, а также ее очистки. В будущем возможно создание миниатюрных установок, которые будут использоваться в автомобилях для безопасного получения водорода из воды. Водород станет источником энергии, а машину можно будет заправлять обычной водой.
Похожие темы:
электролизная — это… Что такое электролизная?
- электролизная
- electrolysis unit
электролизная
(напр. на ТЭС, АЭС)
[А.С.Гольдберг. Англо-русский энергетический словарь. 2006 г.]Тематики
- энергетика в целом
EN
Русско-английский словарь нормативно-технической терминологии. academic.ru. 2015.
- электролизер с ртутным катодом
- электролизная ванна
Смотреть что такое «электролизная» в других словарях:
электролизная — (напр. на ТЭС, АЭС) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN electrolysis unit … Справочник технического переводчика
Электролизная металлизация — Electroless plating Электролизная металлизация. (1) Процесс, в котором металлические ионы в разбавленном водном растворе осаждаются на детали посредством автокаталитического химического восстановления. (2) Отложение проводящего материала из… … Словарь металлургических терминов
электролизная ванна — Смотри электролизная (электролитическая) ванна … Энциклопедический словарь по металлургии
электролизная (электролитическая) ванна — [electrolyzer] емкость с электролитом для проведения в ней электролиза, электролитического рафинирования или гальванотехнического процесса. Смотри также: Ванна шлаковая ванна сварочная ванна ванна для термической обработки … Энциклопедический словарь по металлургии
электролизная очистка — Syn: электролизное очищение … Металлургический словарь терминов
Блочная электролизная установка — (БЭУ) комплектная установка по получению водорода, состоящая из нескольких электролизеров, сблокированных в один агрегат, и имеющая единую аппаратуру… Источник: Постановление Госгортехнадзора РФ от 06.06.2003 N 75 Об утверждении Правил… … Официальная терминология
Водородная (электролизная) установка — агрегатированная установка, совокупность нескольких аппаратов и устройств на базе электролизера, предназначенная для получения водорода и кислорода, а также отделения их друг от друга, электролита и влаги, для обеспечения систем регуляции… … Официальная терминология
Блочная электролизная установка (БЭУ)
Водородная (электролизная) установка — агрегатированная установка, совокупность нескольких аппаратов и устройств на базе электролизера, предназначенная для получения водорода и кислорода, а также отделения их друг от друга, электролита и влаги, для обеспечения систем регуляции… … Словарь-справочник терминов нормативно-технической документации
ПБ 03-598-03: Правила безопасности при производстве водорода методом электролиза воды — Терминология ПБ 03 598 03: Правила безопасности при производстве водорода методом электролиза воды: «Допускается» данное решение применяется в виде исключения как вынужденное. Определения термина из разных документов: «Допускается» «Как правило»… … Словарь-справочник терминов нормативно-технической документации
электролизная — с русского на все языки
См. также в других словарях:
электролизная — (напр. на ТЭС, АЭС) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN electrolysis unit … Справочник технического переводчика
электролизная ванна — электролитическая ванна Емкость с электролитом для проведения в ней электролиза, электролитич. рафинирования или гальванотехнич. процесса. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом Синонимы электролитическая ванна EN… … Справочник технического переводчика
Электролизная металлизация — Electroless plating Электролизная металлизация. (1) Процесс, в котором металлические ионы в разбавленном водном растворе осаждаются на детали посредством автокаталитического химического восстановления. (2) Отложение проводящего материала из… … Словарь металлургических терминов
электролизная ванна — Смотри электролизная (электролитическая) ванна … Энциклопедический словарь по металлургии
электролизная (электролитическая) ванна — [electrolyzer] емкость с электролитом для проведения в ней электролиза, электролитического рафинирования или гальванотехнического процесса. Смотри также: Ванна шлаковая ванна сварочная ванна ванна для термической обработки … Энциклопедический словарь по металлургии
электролизная очистка — Syn: электролизное очищение … Металлургический словарь терминов
Блочная электролизная установка — (БЭУ) комплектная установка по получению водорода, состоящая из нескольких электролизеров, сблокированных в один агрегат, и имеющая единую аппаратуру… Источник: Постановление Госгортехнадзора РФ от 06.06.2003 N 75 Об утверждении Правил… … Официальная терминология
Водородная (электролизная) установка — агрегатированная установка, совокупность нескольких аппаратов и устройств на базе электролизера, предназначенная для получения водорода и кислорода, а также отделения их друг от друга, электролита и влаги, для обеспечения систем регуляции… … Официальная терминология
Блочная электролизная установка (БЭУ) — комплектная установка по получению водорода, состоящая из нескольких электролизеров, сблокированных в один агрегат, и имеющая единую аппаратуру. Источник: ПБ 03 598 03: Правила безопасности при производстве водорода методом электролиза воды … Словарь-справочник терминов нормативно-технической документации
Водородная (электролизная) установка — агрегатированная установка, совокупность нескольких аппаратов и устройств на базе электролизера, предназначенная для получения водорода и кислорода, а также отделения их друг от друга, электролита и влаги, для обеспечения систем регуляции… … Словарь-справочник терминов нормативно-технической документации
ПБ 03-598-03: Правила безопасности при производстве водорода методом электролиза воды — Терминология ПБ 03 598 03: Правила безопасности при производстве водорода методом электролиза воды: «Допускается» данное решение применяется в виде исключения как вынужденное. Определения термина из разных документов: «Допускается» «Как правило»… … Словарь-справочник терминов нормативно-технической документации
электролизный — это… Что такое электролизный?
- электролизный
.
- ЭЛЕКТРОЛИЗ
- электролитический
Смотреть что такое «электролизный» в других словарях:
электролизный — ая, ое. électrolyse f. спец. Отн. к электролизу. Электролизный процесс. БАС 1. || Предназначенный для электролиза. Электролизная ванна. Электролизный сосуд. БАС 1. || Получаемый путем электролиза. Электролизная медь. БАС 1. Лекс. БАС 1:… … Исторический словарь галлицизмов русского языка
электролизный — прил., кол во синонимов: 1 • электролитический (2) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
электролизный яд — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN electrolysis poison … Справочник технического переводчика
Электролизный — прил. 1. соотн. с сущ. электролиз, связанный с ним 2. Свойственный электролизу, характерный для него. 3. Получаемый путём электролиза. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
электролизный — электролизный, электролизная, электролизное, электролизные, электролизного, электролизной, электролизного, электролизных, электролизному, электролизной, электролизному, электролизным, электролизный, электролизную, электролизное, электролизные,… … Формы слов
электролизный — электр олизный … Русский орфографический словарь
электролизный — ая, ое. Спец. к Электролиз. Э. цех. Э ая ванна. // Получаемый путём электролиза. Э ая медь … Энциклопедический словарь
электролизный — ая, ое.; спец. а) к электролиз Электро/лизный цех. Э ая ванна. б) отт. Получаемый путём электролиза. Э ая медь … Словарь многих выражений
электролизный — электр/о/лиз/н/ый … Морфемно-орфографический словарь
Казахстанский электролизный завод — АО «Казахстанский электролизный завод» (КЭЗ) единственный производитель алюминия в Казахстане,[1] расположен в Павлодаре. Это промышленное предприятие стоимостью $900 млн представляет собой крупнейшее в Казахстане частное… … Википедия
Электролиз — MozillaWiki
Спасибо
(5/1/2018) Проект электролиза официально завершен. Mozilla продолжает работать над масштабированием модели процесса Gecko с помощью новых проектов и работ, включая нашу инициативу «Процесс на происхождение» — Project Fission. Опора и спасибо всему нашему сообществу за помощь в доставке этого кузова. Мы не могли бы успешно отправить это без вашей помощи!
Обзор
Функциональность Electrolysis позволяет размещать, отображать или выполнять веб-контент в фоновых дочерних процессах, которые взаимодействуют с «родительским» браузером Firefox через различные протоколы ipdl.Двумя основными преимуществами этой модели являются безопасность и производительность. Улучшения безопасности достигаются с помощью изолированной программной среды безопасности, улучшения производительности обусловлены тем, что несколько процессов лучше используют доступную вычислительную мощность клиента.
Электролизные дочерние процессы в настоящее время используются для следующих задач в Firefox:
- Устаревший плагин NPAPI хостинг
- Воспроизведение мультимедиа («Gecko Media Plugin», a.k.a. «GMP»)
- Веб-контент («процессы контента»)
- [Fx53] Процесс GPU (только для Windows) ошибка 1264543
- [Fx54] file: // ошибка процесса доступа к URL 1147911
- [Fx55] Ошибка веб-расширений 1190679
- [Fx55, Fx56] ServiceWorker и в будущем ошибка потоков SharedWorker 1231208
В будущем дочерние процессы Electrolysis могут использоваться для решения других задач браузера, включая аудио, работу в сети (ошибка 1322426), PDFium и Pepper Flash (ошибка 558184).
В документации Mozilla «Электролиз» часто обозначается как «e10s».
Тестирование
Ночной / Аврора
Если вы используете Nightly, e10s-multi по умолчанию включен с 4 процессами. Вскоре в Firefox 54 Aurora также будет включен e10s-multi (4 процесса) по умолчанию. Для управления функциональностью электролиза доступен пользовательский флажок. Откройте «Настройки» и установите флажок «Включить несколько процессов», а затем перезапустите браузер:
Firefox Beta
Если вы в настоящее время используете Firefox Beta, возможно, вы уже тестируете e10s, проверьте о: support и найдите число больше 0 в записи «Многопроцессорная Windows».Если вы хотите подписаться, чтобы помочь нам протестировать, откройте : config и переключите browser.tabs.remote.autostart на true. При следующем перезапуске e10s должны быть активны.
Firefox Release
Если вы используете Firefox 48 или более позднюю версию, возможно, вы уже используете e10s. Проверьте о: поддержка и найдите число больше 0 в записи «Многопроцессорная Windows». Если вы хотите подписаться, откройте about: config и переключите browser.tabs.remote.autostart на true. При следующем перезапуске e10s должны быть активны.
Force Enable
Если вы пытались включить e10s, следуя приведенной выше инструкции, но ваш about: support указывает, что e10s отключен (например, доступность, дополнения могут вызвать это), вы можете включить e10s для целей тестирования. В пределах about: config создайте новый логический префикс с именем browser.tabs.remote.force-enable и установите для него значение true. Это не поощряется, используйте его на свой страх и риск!
Расписание и статус
Посетите вики-страницу Multiple Content Process для получения дополнительной информации об этапах выпуска, критериях выпуска и графике постепенного выпуска e10s-multi.
Расписание
Следующее расписание охватывает развертывание функции единого контента для выпуска сборок до Firefox 54. Многопроцессорность покрывается, начиная с Nightly 54.
Какой процент населения на самом деле имеет e10s включен?
| Дата | Ствол | Аврора | Beta | Выпуск|
|---|---|---|---|---|
| 2015-04-30 | 40 по умолчанию (работает на m5) | 39 от | 38 от | от 37 |
| 2015-05-11 | 41 по умолчанию (работает на m6) | 40 подсказок | 39 от | 38 от |
| 2015-06-29 | 42 по умолчанию (работает на m7 / m8) | 41 подсказка | 40 от | 39 от |
| 2015-08-10 | 43 по умолчанию (работает на m8) | 42 по умолчанию | 41 от | от 40 |
| 2015-09-21 | 44 по умолчанию | 43 по умолчанию | 42 от | 41 выкл |
| 2015-11-02 | 45 по умолчанию | 44 по умолчанию | 43 от | 42 выкл |
| 2015-12-14 | 46 по умолчанию | 45 по умолчанию | 44 A / B [1] | от 43 |
| 2016-01-25 | 47 по умолчанию | 46 по умолчанию | 45 A / B [1] | 44 от |
| 2016-03-07 | 48 по умолчанию | 47 по умолчанию | 46 A / B [1] | с 45 |
| 2016-04-25 | 49 по умолчанию | 48 по умолчанию | 47 50% [1] [2] | от 46 |
| 2016-06-06 | 50 по умолчанию | 49 по умолчанию | 48 [1] [2] | 47 от |
| 2016-08-01 | 51 по умолчанию [6] | 50 по умолчанию | 49 [2] [4] | 48 ВКЛ [3] |
| 2016-09-19 | 52 по умолчанию [7] [8] | 51 по умолчанию [6] | 50 по умолчанию [4] | 49 ВКЛ [5] |
| 2016-11-07 | 53 по умолчанию [8] | 52 по умолчанию [7] | 51 по умолчанию [6] | 50 ВКЛ [5] |
| 2017-01-24 | 54 по умолчанию | 53 по умолчанию | 52 по умолчанию [7] | 51 ВКЛ |
| 2017-03-07 | 55 по умолчанию [9] | 54 по умолчанию [8] | 53 по умолчанию | 52 ВКЛ |
| 2017-04-18 | 55 по умолчанию | не указано | 54 по умолчанию | 53 ВКЛ |
| 2017-06-13 | 56 по умолчанию | не указано | 55 по умолчанию | 54 ВКЛ [10] |
[1] квалифицированные пользователи: пользователи, которые не используют надстройки и не активировали поддержку специальных возможностей в течение 30 дней.
[2] полный цикл в течение всего периода бета-тестирования
[3] 1% квалифицированных пользователей со скоростью до 100% в течение цикла выпуска
[4] надстройки из белого списка + надстройки, созданные как тестирование WebExtension на бета-версии , полный цикл
[5] Добавленные в белый список надстройки + надстройки, созданные как поставка WebExtension в Выпуске
[6] Поддержка сенсорного экрана A11y + Windows 8 включена, не едет поезда
[7] Поездка Windows 8 едет поезда
[8] E10s Multi включен, поезд не едет
[9] A11y включен для Windows
[10] E10s multi включен, поезд едет
[*] означает, что цель для релиза еще не запланирована
Расписание дополнений
Следующий график развертывания Electrolysis, поскольку он выпускается специально для дополнений.Каждый выпуск Firefox будет добавлять все больше и больше дополнений в группу пользователей, которые получают многопроцессорный Firefox.
Пользователи с надстройками, еще не входящими в группу для получения многопроцессорной обработки, продолжат запуск Firefox (как и прежде) без включенной e10s. В блоге «Дорога к 57» есть подробности, и здесь можно посмотреть расписание.
| Версия | когорта |
|---|---|
| 49 | ограниченный экспериментальный набор расширений и всех расширений WebExtensions |
| 50 | все расширения помечены как «multiprocessCompatible» и все расширения Web [1] |
| 51 | Возвращение к критериям выпуска Fx 50.Были включены все расширения и все WebExtensions [1], [2], [3], а также тестирование 770 надстроек в бета-версии, которые не были отмечены в любом случае (начальное расширение). |
| 52 | все расширения помечены как «multiprocessCompatible» и все расширения Web [1] |
| 53 | все расширения помечены как «multiprocessCompatible» и все расширения WebExtensions [1]. |
| 54 | все расширения помечены как «multiprocessCompatible» и все расширения WebExtensions [1]. |
| 55 | все расширения помечены как «multiprocessCompatible» и все расширения WebExtensions [1]. |
| 56 | все расширения помечены как «multiprocessCompatible» и все расширения WebExtensions [1]. |
| 57 | Поддерживается ТОЛЬКОвеб-расширений [4] |
[1] Перед переходом каждой стадии от бета-версии к выпуску необходимо выполнить критерии выпуска (сбои, рывок и т. Д.). Мы откладываем переход к версии, если в бета-версии обнаружены проблемы.
[2] Изначально будут доступны Shims, которые помогут определенным дополнениям с совместимостью. Это временная мера из-за потенциальных ограничений, которые могут повлиять на пользовательский опыт.
[3] За исключением расширений, явно помеченных как НЕ multiprocessCompatible.
[4] Более подробную информацию в блоге или в более широком расписании дополнений смотрите в деталях о том, что будет разрешено
Для получения информации о развертывании поддержки дополнений см. Вики проекта Add-on / e10s.
План поэтапного развертыванияЧтобы ознакомиться с краткой информацией о плане развертывания, см. Блог Асы.
Windows XP
Из-за проблем со стабильностью Windows XP в настоящее время не использует e10s на канале выпуска. XP и Vista переместятся в Extended Support Release (ESR) 45, когда 45 объединятся в выпуск (ошибка 1303827). Таким образом, в будущем не планируется поддерживать e10s для XP / Vista.
Еженедельные отчеты о состоянии
2017
2016
2015
Эксперименты
Специальная страница для экспериментов: эксперименты E10s
Содействие
Самый простой способ помочь — это протестировать релиз с включенными e10s и сообщить об ошибке при их обнаружении.Пожалуйста, попробуйте найти дубликаты до подачи заявки.
Для разработчиков, заинтересованных в помощи, у MDN есть хорошее введение в e10s, полезное как для Firefox, так и для разработчиков дополнений.
Безопасность Песочница
См. Вики-страницу Security Sandbox для получения дополнительной информации и статуса.
Поддержка доступности
См. Вики-страницу доступности e10s для подробностей реализации поддержки.
Совместимость дополнений
Авторам надстроекследует обратиться к Руководству по миграции надстроек MDN Firefox для портирования существующих надстроек на e10s.Для получения общей информации о проектировании см. Документацию Multiprocess Firefox MDN. Совместимость тестирования дополнений в настоящее время доступна по адресу https://arewewebextensionsyet.com/.
Для получения дополнительной информации об устранении проблем дополнения и развертывании e10s для пользователей дополнения см. Вики-страницу проекта дополнения.
Вехи прошлого
- 2014-09-11 — ошибка 1064885 — Включите опцию выбора для Nightly
- 2014-11-13 — ошибка 1093691 — включена для ночных сборок
- 2015-05-08 — ошибка 1161260 — Включите опцию опции Аврора
- 2015-07-28 — ошибка 1182097 — Отключена на Авроре примерно на 1 неделю из-за ошибки в a11y, вызывающей
- 2015-07-31 — ошибка 1188605 — включена для сборок Аврора
- 2015-12-15 — ошибка 1229104 — бета-тестирование
- 2016-08-01 — Включено для пользователей, не являющихся надстройками, в Выпуске 48 / Бета-тестирование пользователей надстроек в 49
Связь
человек
| Инженерное управление | |
| Управление продуктом | |
| Управление проектом |
|
| QA |
|
| Команда разработчиков |
|
Примечания к собранию
Ссылка
Ссылка
Списки ошибок
Блокираторы включения по ночам
блокираторы подъема Aurora (плюс dev.инструменты)
бета-блокаторы
GA Блокаторы
Сводные спискиСписки Devtools
Ошибка производительности (e10s-perf)
Будущее
Списки сортировки
- e10s Список сортировки: https://is.gd/S0iUXW
- Список сортировки e10s-perf: http://is.gd/5R5Leo
- e10s needinfo Список сортировки: http://is.gd/MoraEb
- tracking-e10s:? Список конкретных потребностей: http://is.gd/vsPqdk
- Список дополнительных сортировок: http: // is.GD / P2aqLC
- tracking-e10s: + список: http://is.gd/ybrg68
- минус потребность в информации
- минус Сводка, содержащая «прерывистый», «тест», «аддон», «дополнение»
- минус Ключевые слова, содержащие слова «мета», «qawanted»
- минус ошибки с установленным приоритетом
- не блокирует баг apz-desktop, баг e10s-тестов, баг e10s-perf, баг e10s-аддонов, баг e10s-gfx, баг e10s-sdk, баг e10sa11y2, баг e10s-ime, баг dte10s, баг e10s-social, баг e10s-multi, жучок e10s-жгут
- tracking-e10s: + needinfos Список: http: // is.Б-г / Ядитг Блокаторы RTL
- : http://is.gd/cKUiNa
доп. Трекеры
Кандидаты на повышение 9009: (отслеживание M9 и P1 + ошибки исправлены в FF 48, но не 47)
,Электролиз — это научный способ «расщепления» веществ. Электролиз означает «электрическое расщепление» и включает разделение веществ с помощью электрического тока.
Металлы выше углерода в ряду реактивности (калий, натрий, литий, кальций, магний и алюминий) извлекаются электролизом.
Электролиз используется в горнодобывающей промышленности для отделения химически активных металлов от их руд после их извлечения из земли.Гальваника также используется для покрытия (покрытия) предметов металлом, потому что это стоит дешевле, чем, например, использование чистого золота для изготовления ювелирных изделий.
Многие салоны красоты используют электролиз или электрологию для удаления волос. Это делается путем «электрического удара» волос, чтобы они расщеплялись вдоль корня.
Электролиз заставляет анионы (отрицательные ионы) идти к аноду (положительный электрод), а катионы (положительные ионы) уходят к катоду (отрицательный электрод). Так, например, кислород пойдет на анод, а железо пойдет на катод.
 | Wikimedia Commons имеет СМИ, связанные с электролизом . |
 Эта короткая статья о химии может быть сделана дольше. Вы можете помочь Википедии, добавив к ней . ,
Эта короткая статья о химии может быть сделана дольше. Вы можете помочь Википедии, добавив к ней . ,Электролиз — это окислительно-восстановительный процесс, который происходит на электродах, в течение которых электрический ток проходит через расплав или раствор. Электролиз — это еще один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно проводить в домашних условиях. Нужен источник тока, два электрода (виды электродов, любые случаи этих процессов, которые будут обсуждаться позже) и, конечно же, электролит.Электролит представляет собой раствор, который проводит электрический ток. Существует электролиза растворов и электролиза расплавов . Оба эти процесса существенно отличаются друг от друга. Разница в том, что в присутствии растворителя. При электролизе растворов помимо ионов вещества, ионы растворителя участвуют в процессе. При электролизе плавится — только ионы самого вещества. Первый опыт проведем с целью получения водорода и кислорода. Следующий опыт электролиза получит чистая медь (Cu). Для этого нам понадобится раствор сульфата меди CuSO 4 , который содержит растворенную медь.Медь находится после водорода в диапазоне напряжений металлов, поэтому она будет выделяться на электроде. У нас было 2 опыта электролиза растворов и можно подвести итог: Будет еще опыт в электролизе. На этот раз мы пропустим ток через раствор хлорида натрия (NaCl).Но я должен предупредить вас, этот электролиз должен проводиться в хорошо проветриваемом помещении, так как выделяется из раствора чистого газа — хлор (Cl 2 ) очень токсичен. Если вы хотите собирать этот газ (или другой газ), вы можете использовать следующую схему: Итак, начнем. Готовят раствор хлорида натрия (NaCl). Положительный полюс источника питания соединяют с инертным электродом (например, графитовым стержнем), отрицательный полюс может представлять собой любой подходящий материал, проводящий ток.Поместите в раствор электроды и включите питание. Через несколько секунд вы уже можете почувствовать неприятный запах хлора (это хлор!). Не переусердствуйте с запахом! Хлор выделяется в виде маленьких пузырьков на аноде («+»). Чем дольше это займет процесс электролиза, тем больше концентрация хлора будет около электролита. Если вы соберете хлор в пробирку или банку (хлор тяжелее воздуха, его найдут на дне), не пытайтесь «понюхать» его в банке — можете сильно отравиться! (Статья о хлоре). Электролиз расплавов При электролизе плавится , ионы вещества, которое подвергается электролизу, участвуют только в процессе. Например, если подвергнуть электролизу расплавленный хлорид натрия (NaCl), на аноде будет выделяться газ — хлор (Cl 2 ), но вместо водорода чистого металла натрий (Na) восстанавливается на катоде.Именно так в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы. Вернуться на главную страницу | Химическая реакция. Типы химических реакций Сложные вещества. Жесткость воды Сплавы чистых металлов Простое вещество Занимательные эксперименты.Эксперименты на дому Химические опыты |
Статья о электролизе в «Свободном словаре»
совокупность электрохимических окислительно-восстановительных процессов, протекающих на электродах, погруженных в электролит при прохождении электрического тока через электролит. Электролиз лежит в основе электрохимического метода лабораторного и промышленного производства различных веществ, как простых веществ (электролиз в узком смысле слова), так и сложных ( см. ).
Первые исследования и применения электролиза датируются концом 18 и началом 19 веков, когда электрохимия становилась наукой ( см. ).Большое значение в разработке теоретических основ электролиза имело открытие М. Фарадеем (1833–34) точной зависимости между количеством электрического тока, потребляемого при электролизе, и количеством вещества, вырабатываемого на каждом электроде ( см. FARADAYS ЗАКОНЫ. ) Промышленное использование электролиза стало возможным после разработки мощных генераторов постоянного тока в 1870-х годах.
Уникальной особенностью электролиза является пространственное разделение процессов окисления и восстановления.Электрохимическое окисление происходит на аноде, а восстановление происходит на катоде. Электролиз проводится в специальных аппаратах, называемых электролизерами. Электролиз индуцируется энергией подачи постоянного тока и энергией, выделяемой при химических превращениях на электродах. Мощность, потребляемая при электролизе, расходуется на увеличение свободной энергии Гиббса системы в процессе образования желаемых продуктов и частично рассеивается в виде тепла в ходе преодоления сопротивления в электролизере и в других частях электрическая цепь ( см. GIBBS FREE ENERGY ).
В результате электролиза на катоде происходит восстановление ионов или молекул электролита с образованием новых продуктов. Катионы принимают электроны и превращаются в ионы с более низкой степенью окисления или в атомы, например, при восстановлении ионов железа (Fe 3+ + e — → Fe 2+ ) и электроосаждении меди ( Cu 2+ + 2e — → Cu). Нейтральные молекулы могут непосредственно участвовать в превращениях на катоде или реагировать с промежуточными продуктами катодного процесса.Окисление ионов или молекул, обнаруженных в электролите или в материале анода (анод растворяется или окисляется), происходит на аноде, например, выделение кислорода (4OH — → 4e — + 2H 2 O + O 2 ), выделение хлора (2Cl — → 2e — + Cl 2 ), образование хромата (Cr 3+ + 3OH — + H 2 O → CrO 4 2– + 5H + + 3e — ), растворение меди (Cu → Cu 2+ + 2e — ) и окисление алюминия (2A1 + 3H 2 O → Al 2 O 3 + 6H + + 6e — ).Электрохимическое производство вещества (в атомном, молекулярном или ионном состоянии) включает передачу одного или нескольких зарядов от электрода к электролиту (или наоборот) в соответствии с уравнением химической реакции. В последнем случае это достигается, как правило, посредством последовательности одноэлектронных шагов, с образованием на электроде промежуточных ионов или радикальных частиц, которые часто остаются на электроде в адсорбированном состоянии.
Скорости электродных реакций зависят от состава и концентрации электролита, материала электрода, потенциала электрода и температуры, а также других факторов.Скорость каждой реакции определяется скоростью передачи электрического заряда на единицу поверхности электрода в единицу времени. Таким образом, плотность тока служит мерой скорости.
Количество продукта, образующегося при электролизе, определяется законами Фарадея. Если несколько продуктов образуются одновременно на каждом электроде в результате нескольких электрохимических реакций, то величина тока (выраженная в процентах), потребляемая при образовании продукта каждой из этих реакций, называется текущей эффективностью данного продукта.
Преимущества электролиза перед химическими методами для производства различных продуктов заключаются в относительной простоте контроля скорости и селективности реакции путем регулирования тока. Условия электролиза легко контролируются. Как следствие, процессы могут проводиться либо в «самых мягких», либо в «самых энергичных» условиях окисления или восстановления и производить самые сильные окислители и восстановители, используемые в науке и промышленности. Электролиз является основным методом промышленного производства алюминия, хлора и гидроксида натрия и важным методом производства фтора, щелочных металлов и щелочноземельных металлов.Это эффективный метод рафинирования металлов. Водород и кислород образуются при электролизе воды. Электрохимический метод используется для синтеза различных классов органических соединений и многих окислителей (персульфатов, перманганатов, перхлоратов и перфторорганических соединений). Использование электролиза для обработки поверхностей включает процессы катодного гальванического покрытия в машиностроении, приборостроении, авиационной, электротехнической и электронной промышленности, а также в процессах анодного полирования и травления, механического анодного шлифования и окисления ( анодирование) металлических изделий.Металлические установки и конструкции защищены от коррозии электролизом в контролируемых условиях (анодная и катодная защита).