Газ для: Коммерческие автомобили ГАЗ — официальный сайт завода – Газобаллонное оборудование в автомобиле: все за и против — журнал За рулем
Автомобиль на природном газе — Википедия
Материал из Википедии — свободной энциклопедии
Автомобиль на природном газе — один из видов автомобилей на альтернативном топливе — они используют компримированный природный газ (метан) или сжиженный природный газ (пропан). К этому классу не относятся автомобили, использующие в качестве топлива пропан-бутановую смесь, так как это принципиально другая технология. Мировыми лидерами по количеству автомобилей на природном газе являются: Иран — 3,3 миллиона автомобилей, Пакистан — 3,1 миллиона автомобилей, Аргентина — 2,17 миллиона автомобилей, Бразилия — 1,73 миллиона автомобилей, Индия — 1,50 миллиона автомобилей. Азиатско-Тихоокеанский регион лидирует по количеству автомобилей на природном газе с 8,45 миллионами автомобилей, за ним идет Латинская Америка с 4,43 миллионами автомобилей. 90 % автомобилей на природном газе в Латинской Америке двухтопливные — они могут использовать в качестве моторного топлива как компримированный природный газ (метан), так и бензин.
Большинство автомобилей с бензиновым двигателем могут быть переоборудованы на использование метана в качестве моторного топлива, и после переоборудования становятся двухтопливными. Лёгкий коммерческий транспорт с дизельными двигателями также могут быть переоборудованы под использование метана в качестве моторного топлива — автомобиль будет работать на смеси дизельного топлива и метана в процентном соотношении 60 % дизеля к 40 % метана. Также большинство мировых автоконцернов выпускают новые автомобили на природном газе — в Россию поставляют автомобили Volkswagen: Caddy, Также российские автопроизводители выпускают автомобили на природном газе: это ГАЗ с моделью Газель[источник не указан 136 дней].
Автомобильные газозаправочные станции компримированного природного газа могут быть построенные везде, где существуют магистральные газопроводы. Такая станция представляет собой мини-завод по сжатию природного газа. В баллонах автомобиля компримированный природный газ находится под давлением 200 атмосфер.
Между КПГ и СПГ, которые используются в качестве моторного топлива, существуют технологические различия. КПГ (компримированный природный газ) в качестве моторного топлива. Компримированный природный газ — это сжатый газ, находящийся под давлением в 200 атмосфер. В качестве бака для него используют цельнометаллические или металлопластиковые баллоны.
Сжиженный природный газ — это природный газ, который был охлажден до состояния криогенной жидкости. СПГ в 3 раза плотнее чем КПГ. Из-за своего криогенного состояния, СПГ хранится в специальных изолированных (но не герметично) резервуарах — сосудах Дьюара. В них устанавливается испаритель, который превращает СПГ в газ для топливной системы.
Всего в России к концу 2013 года было зарегистрировано 86 012 автомобилей, использующих КПГ (метан) в качестве моторного топлива. Большинство автомобилей, использующих КПГ в России — это лёгкий коммерческий транспорт. Наиболее развито использование КПГ в Южном Федеральном Округе
Цены на газ для физических лиц
Направления использования газа
Цена (С НДС 20%)
Приготовление пищи и нагрев воды с использованием газовой плиты (в отсутствие других направлений и использования газа)
Нагрев воды с использованием газового водонагревателя при отсуствии центрального горячего водоснабжения (в отсутствие других направлений использования газа)
Приготовление пищи и нагрев воды с использованием газовой плиты и нагрев воды с использованием газового водонагревателя при отсутствии центрального горячего водоснабжения (в отсутствие других направлений использования газа)
Отопление с одновременным использованием газа на другие цели (кроме отопления и (или) выработки электрической энергии с использованием котельных всех типов и (или) иного оборудования, находящихся в общей долевой собственности собственников помещений в многоквартирных домах) при наличии приборов учета газа
5 530,07
руб/1000 м³
Индивидуальное (поквартирное) отопление жилых помещений (жилых домов, квартир, комнат) в пределах стандарта нормативной площади жилого помещения при отсутствии приборов учета газа
5 530,07
руб/1000 м³
Индивидуальное (поквартирное) отопление жилых помещений (жилых домов, квартир, комнат) в сверх стандарта нормативной площади жилого помещения при отсутствии приборов учета газа
6 849,93руб/1000 м³
На прочие цели (отопление нежилых помещений)
7 075,08
руб/1000 м³
Газированная вода — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 июня 2019; проверки требуют 26 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 июня 2019; проверки требуют 26 правок.
 Автоматы по продаже газированной воды. СССР, 1964
Автоматы по продаже газированной воды. СССР, 1964Газиро́ванная[1] вода́ (устар. «шипучие воды», просторечное — «газировка») — прохладительный напиток из минеральной или обычной воды, насыщенной углекислым газом.
Существует три вида газированной воды по уровню насыщения углекислым газом по ГОСТ 28188-2014:
- слабогазированная при уровне углекислого газа от 0,2 до 0,3 %;
- среднегазированная — 0,3-0,4 %;
- сильногазированная — более 0,4 % насыщения.
Газация происходит двумя способами:
- Механическим — введение и насыщение жидкости диоксидом углерода: фруктовые и минеральные воды, газированные или шипучие вина и вода. При этом напитки газируются в специальных аппаратах — сифонах, сатураторах, акратофорах или металлических баках под давлением, предварительно охлаждая и выводя из жидкости воздух. Обычно напитки насыщают до 5—10 г/л. Газирование воды углекислым газом не обеззараживает её.
- Химическим — напиток газируется углекислотой при брожении: пиво, бутылочное и акратофорное шампанское, игристые вина, сидр, хлебный квас, либо при взаимодействии кислоты и питьевой соды — сельтерская вода (она же «содовая»).
Альтернативные углекислоте газы[править | править код]
Производится и продаётся газированная вода, насыщенная либо смесью углекислого газа и закиси азота, либо кислородом.
Природная газированная вода известна с древнейших времён и использовалась в лечебных целях. Гиппократ посвятил этой воде целую главу своего труда и велел больным не только пить её, но и купаться в ней. В XVIII веке минеральную воду из источников начали разливать в бутылки и развозить по миру. Однако она стоила весьма дорого и к тому же быстро выдыхалась. Поэтому позже были предприняты попытки искусственно загазировать воду.
Первому создать газированную воду удалось английскому химику Джозефу Пристли в 1767 году. Это произошло после экспериментов с газом, выделяющимся при брожении в чанах пивоваренного завода. Далее швед Тоберн Бергман в 1770 году сконструировал аппарат, позволяющий под давлением, с помощью насоса, насыщать воду углекислыми пузырьками и назвал его сатуратором (от лат. saturo — насыщать).
Первым промышленное производство газированной воды начал Якоб Швепп. Он в 1783 году усовершенствовал сатуратор и создал промышленную установку для выпуска газированной воды. В начале XIX века Швепп для удешевления производства стал применять для газирования обычную пищевую соду и газированную воду стали называть «содовая». Новинка быстро распространилась по Англии (такой водой стали разбавлять крепкие алкогольные напитки) и её колониям, позволив Швеппу основать компанию «J.Schweppe&Co», от которой пошла торговая марка Schweppes.
В отличие от США, где газированная вода в основном продавалась разлитой в бутылки, в других странах было принято потреблять её из перезаправляемых сифонов — как маленьких домашних, так и больших, устанавливаемых в кафе и барах. Позже появились и уличные автоматы по продаже газированной воды. В дореволюционной России бутилированная вода считалась «господским» напитком, — её называли зельтерской (сельтерской), по названию минеральной воды, изначально бравшейся из источника Нидерзельтерс (Niederselters). Одним из производителей, например, был петербургский ресторатор Иван Излер в 30-х годах XIX века.
Во времена «сухого закона» в США газированные напитки заменяли (а иногда и маскировали) запрещённые тогда алкогольные напитки.
Популярные марки[править | править код]
- Schweppes (изначально — Швейцария, потом Великобритания и США) — с 1783 г.
- Dr Pepper (США) — с 1885 г.
- «Кока-Кола» (США) — с 1886 г.
- «Тархун» (изначально — Российская империя, потом СССР и Россия) — с 1887 г.
- «Пепси» (США) — c 1898 г.
- Crush (США) — c 1916 г.
- 7UP (США) — c 1929 г.
- «Фанта» (изначально Третий рейх, потом США) — с 1940 г.
- «Саяны» (СССР) — с 1960 г.
- «Спрайт» (США) — с 1961 г.
- «Байкал» (изначально — СССР, потом Россия) — с 1973 г.
- «Буратино» (СССР)
- «Бионад» (Германия)
- «Mountain Dew» (США) — с 1940 г.
- «Mirinda» (изначально Испания, потом США) — с 1958 г.
Средний американец выпивает 180 литров (вчетверо больше, чем в 1950-е годы) газированной воды в год; средний россиянин — 50 литров, средний китаец — 20 литров воды в год[источник не указан 972 дня].
Из общего объёма производства безалкогольной продукции (в США, где в этой индустрии занято около 200 тыс. человек и производится товаров на 300 млрд долларов в год) газированные напитки составляют 73 %[2].
Свойства углекислого газа в составе газированной воды[править | править код]
Углекислый газ плохо растворяется в воде в отличие от сероводорода, диоксида серы, аммиака и др. Другие газы менее растворимы в воде. Углекислый газ используется как консервант и обозначается на упаковке под кодом Е290.
Согласно «Межотраслевым правилам по охране труда в литейном производстве»[3] в литейных цехах следует предусматривать устройства для обеспечения работников (из расчета 4—5 л на человека в смену) подсоленной газированной водой, содержащей 0,5 % поваренной соли.
Некоторые из газированных напитков содержат в своём составе ионы железа, и по этой причине ими нежелательно запивать лекарства: ионы железа могут образовывать в желудочно-кишечном тракте нерастворимые комплексы с некоторыми лекарственными веществами (например, тетрациклином, линкомицина гидрохлоридом и др.), что снижает всасывание лекарств в ЖКТ[4]:150—151.
- Газированные напитки // Товарный словарь / И. А. Пугачёв (главный редактор). — М.: Государственное издательство торговой литературы, 1960. — Т. IX. — Стб. 1031—1032 — 890 с.
Природный газ, свойства, химический состав, добыча и применение
Природный газ, свойства, химический состав, компоненты и составляющие, добыча и применение.
Природный газ – это газообразная смесь, состоящая из метана и более тяжелых углеводородов, азота, диоксида углерода, водяных паров, серосодержащих соединений, инертных газов.
Природный газ
Происхождение природного газа
Химический состав природного газа, требования ГОСТ
Виды природного газа. Сухой, бедный, тощий, жирный и сырой газы
Компоненты и составляющие природного газа
Физические свойства природного газа
Добыча природного газа
Применение и использование природного газа
Другие виды топлива: биодизель, биотопливо, газойль, горючие сланцы, лигроин, мазут, нефть, попутный нефтяной газ, природный газ, свалочный газ, сланцевая нефть, сланцевый газ, синтез-газ
Природный газ:
Природный газ – это полезное ископаемое, смесь газов, образовавшихся в недрах Земли при анаэробном разложении органических веществ.
Природный газ существует в газообразном, твердом или растворённом состоянии. В первом случае – в газообразном состоянии – он широко распространен и содержится в пластах горных пород в недрах Земли в виде газовых залежей (отдельных скоплений, заключенных в «ловушке» между осадочными породами), а также в нефтяных месторождениях в виде газовых шапок. В растворённом состоянии он содержится в нефти и воде. В твердом состоянии он встречается в виде газовых гидратов (т.н. «горючий лёд») – кристаллических соединений природного газа и воды переменного состава. Газовые гидраты – перспективный источник топлива.
При нормальных условиях (1 атм. и 0 °C) природный газ находится только в газообразном состоянии.
Является самым чистым видом органического топлива. Но для того, чтобы использовать его в качестве топлива из него выделяют его составляющие для отдельного использования.
Природный газ представляет собой легковоспламеняющуюся смесь различных углеводородов и примесей.
Природный газ – это газообразная смесь, состоящая из метана и более тяжелых углеводородов, азота, диоксида углерода, водяных паров, серосодержащих соединений, инертных газов.
Природным он зовется, потому что не является синтетическим. Газ рождается под землей в толще осадочных пород из продуктов разложения органики.
Природный газ распространен в природе гораздо шире, чем нефть.
Не имеет ни цвета, ни запаха. Легче воздуха в 1,8 раза. Горюч и взрывоопасен. При утечке не собирается в низинах, а поднимается вверх.
Характерный запах газа, используемого в быту, обусловлен одорацией – добавлением в его состав одорантов, то есть неприятно пахнущих веществ. Самый распространенный одорант – этантиол, его можно почувствовать в воздухе при концентрации 1 на 50 000 000 частей воздуха. Именно благодаря одорации можно легко устанавливать утечки газа.
Происхождение природного газа:
Существует две теории происхождения природного газа: биогенная (органическая) теория и абиогенная (неорганическая, минеральная) теория.
Впервые биогенную теорию происхождения природного газа в 1759 году высказал М.В. Ломоносов. В далеком геологическом прошлом Земли погибшие живые организмы (растения и животные) опускались на дно водоемов, образуя илистые осадки. В результате различных химических процессов они разлагались в безвоздушном пространстве. Из-за движения земной коры эти остатки опускались все глубже и глубже, где под действием высокой температуры и высокого давления превращались в углеводороды: природный газ и нефть. Низкомолекулярные углеводороды (т.е. собственно природный газ) образовывался при более высоких температурах и давлениях. Высокомолекулярные углеводороды – нефть – при меньших. Углеводороды, проникая в пустоты земной коры, образовывали залежи месторождений нефти и газа. Со временем эти органические отложения и залежи углеводородов уходили глубоко вниз на глубину от одного километра до нескольких километров – их покрывали слои осадочных пород либо под действием геологических движений земной коры.
Минеральную теорию происхождения природного газа и нефти сформулировал в 1877 году Д.И. Менделеев. Он исходил из того, что углеводороды могут образовываться в недрах земли в условиях высоких температур и давлений в результате взаимодействия перегретого пара и расплавленных карбидов тяжелых металлов (в первую очередь железа). В результате химических реакций образуются окислы железа и других металлов, а также различные углеводороды в газообразном состоянии. При этом вода попадает глубоко в недра Земли по трещинам-разломам в земной коре. Образовавшиеся углеводороды, находясь в газообразном состоянии, в свою очередь по тем же трещинам и разломам поднимаются наверх в зону наименьшего давления, образуя в конечном итоге газовые и нефтяные залежи. Данный процесс, по мнению Д.И. Менделеева и сторонников гипотезы, происходит постоянно. Поэтому, уменьшение запасов углеводородов в виде нефти и газа человечеству не грозит.
Химический состав природного газа:
Химический состав добываемого природного газа различается в зависимости от месторождения. В любом случае основным и ценным компонентом является метан (СН4), содержание которого составляет от 70 до 98 %.
В состав добываемого газа входят как углеводородные компоненты (метан СН4 и его гомологи: этан С2Н6, пропан С3Н8, бутан С4Н10, пентан С5Н12, гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т.д. вплоть до доказана С22Н46), так и неуглеводородные компоненты (Ar, H2, He, N2, H2S, водяные пары – H2O, CO, CO2 и пр. серосодержащие соединения и инертные газы). Природный газ также содержит следовые количества других компонентов.
Углеводороды, начиная с этана, считаются тяжёлыми. Они образуются только в процессе образования нефти и также называются специфическими «нефтяными» газами. Они являются обязательным спутником нефтей. Их наличие в отобранных пробах свидетельствует о залежах нефти.
Виды природного газа. Сухой, бедный, тощий, жирный и сырой газы:
Качество газа как топлива, как энергоносителя зависит от содержания в нем метана. По содержанию в добываемом газе метана и тяжёлых углеводородов различают сухие (бедные, тощие) и жирные (сырые, богатые) газы.
Сухой, бедный или тощий газ – это природный горючий газ из группы углеводородных, характеризующийся резким преобладанием в его составе метана, сравнительно невысоким содержанием этана и низким – остальных тяжелых углеводородов. Он более характерен для чисто газовых залежей.
Жирный или сырой газ – природный горючий газ из группы углеводородных, характеризующийся повышенным содержанием (свыше 15 %) тяжелых углеводородов, начиная от пропана C3H8 и выше. Такой состав газов характерен для газоконденсатных и нефтяных месторождений.
В качестве примера для наглядности ниже в таблице приведен состав сухого и сырого газа.
| Состав | Сухой газ*, % объема | Сырой газ*, % объема |
| Метан | 86,3 | 36,8 |
| Этан | 9,6 | 32,6 |
| Пропан | 3,0 | 21,1 |
| Бутан | 1,1 | 5,8 |
| Пентан | – | 3,7 |
* В таблице приведен один из примеров. Реальный состав газов в добываемом природном газе из конкретного месторождения может существенно отличаться от приведенного примера.
Поэтому для углеводородного состава газов применяется понятие «коэффициент сухости», которое представляет собой отношение процентного содержания метана СН4 к сумме его гомологов (этану С2Н6 и выше).
Требования ГОСТ к химическому составу природного газа:
ГОСТом 30319.1-2015 «Газ природный. Методы расчета физических свойств. Общие положения» установлены следующие требования к химическому составу природного газа, транспортируемого по газотранспортным системам:
| Компоненты природного газа | Диапазоны молярных долей компонентов | |
| Метан | 0,7≤ ХСН4<1,0 | |
| Этан | ХС2Н6≤0,10 | |
| Пропан | ХС3Н8≤0,035 | |
| Бутаны в сумме | ХС4Н10≤0,015 | |
| Пентаны в сумме | ХС5Н12≤0,005 | |
| Гексан | ХС6Н14≤0,001 | |
| Азот | ХN2≤0,20 | |
| Диоксид углерода | ХCO2≤0,20 | |
| Остальные компоненты | Молярные доли не должны превышать суммарно 0,0025 | |
Компоненты и составляющие природного газа:
Метан (CH4) – это бесцветный газ без запаха. Легче воздуха. Горюч и взрывоопасен. Представляет опасность для здоровья человека.
Этан (C2H6) – бесцветный газ, без запаха и вкуса. Тяжелее воздуха. Горюч и взрывоопасен. Не используется как топливо. Малотоксичен. Представляет опасность для здоровья человека.
Пропан (C3H8) – бесцветный газ, без запаха. Ядовит. В отличие от метана сжижается при комнатной температуре и сравнительно невысоком давлении (12-15 атм), что позволяет его легко хранить и транспортировать.
Бутан (C4H10) – бесцветный газ, со специфическим запахом. Ядовит. Вдвое тяжелее воздуха.
Пентан (С5Н12) имеет три изомера (нормальный пентан, изопентан и неопентан). Нормальный пентан и изопентан – легколетучие подвижные жидкости с характерным запахом. Неопентан – бесцветный газ с характерным запахом. Горюч и взрывоопасен. Токсичен.
Гексан (С6Н14) – бесцветная жидкость со слабым запахом, напоминающим дихлорэтан. Горюч и взрывоопасен. Токсичен.
Азот (N2) – бесцветный газ, без запаха и вкуса. Весьма инертен. Является основным компонентом воздуха – 78,09 % объёма.
Аргон (Ar) – газ без цвета, вкуса и запаха. Инертен. В 1,3 раза тяжелее воздуха. Не горит. Представляет опасность для здоровья человека.
Водород (H2) – лёгкий бесцветный газ, без вкуса и запаха. В смеси с воздухом или кислородом горюч и взрывоопасен. Легче воздуха.
Гелий (He) – очень лёгкий газ без цвета, вкуса и запаха. Легче воздуха. Инертен, при нормальных условиях не реагирует ни с одним из веществ. Не горит. Представляет опасность для здоровья человека.
Сероводород (H2S) – бесцветный газ со сладковатым вкусом, с характерным неприятным запахом (тухлых яиц, тухлого мяса). Ядовит. Горюч и взрывоопасен. Тяжелее воздуха.
Углекислый газ (CO2) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом). Не горит. Тяжелее воздуха в 1,5 раза. Представляет опасность для здоровья человека.
Физические свойства природного газа:
| Наименование параметра: | Значение: |
| Внешние признаки | без цвета, запаха и вкуса |
| Плотность, кг/м3: | |
| Сухой газообразный | от 0,68 до 0,85 |
| Жидкий | 400 |
| Температура самовозгорания, °C | 650 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 4,4 до 17 |
| Удельная теплота сгорания, МДж/м³ | 28-46 |
| Удельная теплота сгорания, Мкал/м³ | 6,7-11 |
| Удельная теплота сгорания, кВт·ч/м³ | 8-12 |
| Октановое число при использовании в двигателях внутреннего сгорания | 120-130 |
| Легче воздуха в 1,8 раза. При утечке не собирается в низинах, а поднимается вверх. |
Добыча природного газа:
Залежи природного газа находятся глубоко в земле, на глубине от одного до нескольких километров. Поэтому, чтобы добыть его необходимо пробурить скважину. Самая глубокая скважина имеет глубину более 6 километров.
В недрах Земли газ находится микроскопических пустотах – порах, которыми обладают некоторые горные породы. Поры соединены между собой микроскопическими каналами – трещинами. В порах и трещинах газ находится под высоким давлением, которое намного превышает атмосферное. Природный газ движется в порах и трещинах, поступая из пор с высоким давлением в поры с более низким давлением.
При бурении скважины газ вследствие действия физических законов полностью поступает в скважину, стремясь в зону низкого давления. Таким образом, разность давления в месторождении и на поверхности Земли является естественной движущей силой, которая выталкивает газ из недр.
Газ добывают из недр земли с помощью не одной, а нескольких и более скважин. Скважины стараются разместить равномерно по всей территории месторождения для равномерного падения пластового давления в залежи. Иначе возможны перетоки газа между областями месторождения, а также преждевременное обводнение залежи.
Так как добытый газ содержит множество примесей, то его сразу же после добычи очищают на специальном оборудовании, после чего транспортируют потребителю.
Применение и использование природного газа:
Природный газ применяется и используется как топливо, а также как сырье в химической промышленности для получения различных органических вещества, например, пластмасс.
Другие виды топлива:
– биодизель,
– биотопливо,
– газойль,
– горючие сланцы,
– лигроин,
– мазут,
– нефть,
– попутный нефтяной газ,
– природный газ,
– свалочный газ,
– сланцевая нефть,
– сланцевый газ,
– синтез-газ.
Примечание: © Фото //www.pexels.com, //pixabay.com




карта сайта
какой сжиженный природный газ метан вода дома является 4 класс воздух для населения купить содержит формула природный источник тема окружающий мир презентация
сколько сгорание получение компоненты вещества применение составляющие использование масса места теплота давление стоимость м3 температура свойства виды переработка куб сжигание месторождения какой объем плотность добыча расход состав места добычи цена природного газа
цена давление сколько м3 стоимость свойства добыча сгорание использование расход куб запасы производство плотность температура углеводород теплота сгорания объем установки расчет качество сжигание месторождения формула природного газа
газ природный 14 2 2 12018 5
плита под нефть россия гост тариф на сколько стоит компримированный природный газ является какое дома для населения купить страны уголь метан воздух вода перевод газпром баллон значение мира оборудование вещество
газопроводы переработка кг сжижение сеть сигнализаторы какое давление потребление компонент горение виды жиклеры для применение сигнализатор загазованности транспортировка составляющие химические свойства количество поставка характеристика учет природного газа
генератор котлы на природном газе
отопление природным газом
Коэффициент востребованности 10 944
Газ — Википедия

Газ, или газообразное состояние (от нидерл. gas, восходит к др.-греч. χάος (háos)) — одно из четырёх основных агрегатных состояний вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения[1].
Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется па́ром. Реальный газ представляет собой высоко перегретый пар, свойства которого незначительно отличаются от идеального газа. В связи с этим в термодинамическом описании паров и реальных газов следует различать только два состояния — насыщенные пары (двухфазовые системы) и перегретые пары — (однофазовые газообразные состояния)[2]. Существует и другое определение понятия реальный газ, включающее весь диапазон газообразного состояния вещества от насыщенного пара до высоко перегретого и сильно разреженного.
Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма, а стремятся заполнить весь доступный объём (например, сосуда). В планетарном масштабе газ в атмосфере удерживается гравитацией и не образует свободной поверхности.
Газообразное состояние — самое распространённое состояние вещества Вселенной (межзвёздное вещество, туманности, звёзды, атмосферы планет и т. д.). По химическим свойствам газы и их смеси весьма разнообразны: от малоактивных инертных газов до взрывчатых газовых смесей. Понятие «газ» иногда распространяют не только на совокупности атомов и молекул, но и на совокупности других элементарных [квантовых] частиц (то есть на квантовую систему) — фотонов, электронов, броуновских частиц, а также плазму.
Чтобы испарить жидкость, вовсе необязательно её нагревать. Можно уменьшить атмосферное давление поднятием на высоту, либо вакуумированием.
- Идеальный газ — газ, в котором взаимодействие между молекулами сводится к парным столкновениям, причём время межмолекулярного столкновения намного меньше среднего времени между столкновениями. Идеальный газ является простейшим модельным объектом молекулярной физики. В классической (феноменологической) термодинамике идеальный газ — гипотетический, не существующий в природе газ, в точности подчиняющийся уравнению газового состояния Клапейрона — Менделеева: PV=νRT{\displaystyle PV=\nu \;RT}
- Реальный газ — агрегатное состояние вещества (простого тела). Состояние реальных газов достаточно точно описывается уравнением Клапейрона в условиях далёких от температуры конденсации, (высоко перегретые пары), а в условиях, близких к конденсации, где силами молекулярного взаимодействия уже нельзя пренебречь, вместо уравнения Клапейрона — Менделеева используются приближённые эмпирические и полуэмпирические уравнения. Наиболее простым и распространённым является уравнение Ван-дер-Ваальса. Известно немало попыток теоретического вывода уравнения состояния реального газа. Американский физик Д. Майер и советский математик Н. Боголюбов с помощью методов статистической физики вывели уравнение состояния реального газа в наиболее общем виде, включающее так называемые вириальные коэффициенты, являющиеся функциями только температуры. Вириальные коэффициенты не могут быть определены теоретическими методами и должны определяться с помощью экспериментальных данных[3].
- Газ Ван-дер-Ваальса — идеализированный газ, точно подчиняющийся уравнению Ван-дер-Ваальса. Важнейшим свойством этого газа является существование в такой простой модели фазового перехода газ — жидкость.
- Частично или полностью ионизованный газ называется плазмой (иногда называется следующим агрегатным состоянием).
- Также газом в технике и в быту кратко называют природный газ, основу которого составляет газ метан.
Слово «газ» (нидерл. gas) было придумано в начале XVII века фламандским естествоиспытателем Я. Б. ван Гельмонтом для обозначения полученного им «мёртвого воздуха» (углекислого газа). Согласно Я. И. Перельману, Гельмонт писал: «Такой пар я назвал газ, потому что он почти не отличается от хаоса древних»[4].
Не исключено также воздействие немецкого gasen «кипеть».
В России для обозначения газов М. В. Ломоносов употреблял термин «упругие жидкости», но он не прижился.
Макроскопические характеристики[править | править код]
Большинство газов сложно или невозможно наблюдать непосредственно нашими органами чувств, они описываются с помощью четырёх физических свойств или макроскопических характеристик: давлением, объёмом, количеством частиц (химики используют моль) и температурой. Эти четыре характеристики издавна неоднократно исследовались учёными, такими как Роберт Бойль, Жак Шарль, Джон Дальтон, Гей-Люссак и Амедео Авогадро для различных газов в различных условиях. Их детальное изучение в итоге привело к установлению математической связи между этими свойствами, выраженной в уравнении состояния идеального газа.
Основной особенностью газа является то, что он заполняет всё доступное пространство, не образуя поверхности. Газы всегда смешиваются. Газ — изотропное вещество, то есть его свойства не зависят от направления. В случаях, когда силами тяготения можно пренебречь или они уравновешены другими силами, давление во всех точках газа одинаково (см. Закон Паскаля).
В поле сил тяготения плотность и давление не одинаковы в каждой точке, уменьшаясь с высотой по барометрической формуле. Соответственно, в поле сил тяжести неоднородной становится смесь газов. Тяжёлые газы имеют тенденцию оседать ниже, а более лёгкие — подниматься вверх. В поле тяготения на любое тело, погружённое в газ, действует Архимедова сила[5], которую используют для полёта воздушных шаров и других воздухоплавтельных аппаратов, заполненные лёгкими газами или горячим воздухом.
Газ имеет высокую сжимаемость — при увеличении давления возрастает его плотность. При повышении температуры газы расширяются. При сжатии газ может перейти в жидкость, если его температура ниже так называемой критической температуры. Критическая температура является характеристикой конкретного газа и зависит от сил взаимодействия между его молекулами. Так, например, газ гелий можно сжижить только при температуре меньшей, чем 4,2 К.
Существуют газы, которые при охлаждении переходят в твёрдое тело, минуя жидкую фазу. Превращение жидкости в газ называется испарением, а непосредственное превращение твёрдого тела в газ — сублимацией.
Сосуществование с жидкостью[править | править код]
В определённом диапазоне температур и давлений газ и жидкость одного и того же вещества могут сосуществовать в виде равновесной двухфазовой системы. Газ над поверхностью жидкости называют насыщенным паром.
Микроскопические характеристики[править | править код]
Если бы можно было наблюдать газ под мощным микроскопом, можно было бы увидеть набор частиц (молекул, атомов и т. д.) без определённой формы и объёма, которые находятся в хаотическом движении. Эти нейтральные частицы газа изменяют направление только тогда, когда они сталкиваются с другими частицами или стенками ёмкости. Если предположить, что эти взаимодействия (удары) абсолютно упругие, это вещество превращается из реального в идеальный газ. Эта доля с микроскопической точки зрения газа описывается молекулярно-кинетической теорией. Все предпосылки, лежащие в этой теории, можно найти в разделе «Основные постулаты» кинетической теории.
Тепловое движение молекул газа[править | править код]
Важнейшей чертой теплового движения молекул газа — это беспорядочность (хаотичность) движения. Экспериментальным доказательством непрерывного характера движения молекул является диффузия и броуновское движение.
Диффузия — это явление самопроизвольного проникновения молекул одного вещества в другое. В результате взаимной диффузии веществ происходит постепенное выравнивание их концентрации во всех областях занимаемого ими объёма. Установлено, что скорость протекания процесса диффузии зависит от рода веществ и температуры.
Одним из самых интересных явлений, подтверждающих хаотичность движения молекул, является броуновское движение, которое проявляется в виде теплового движения микроскопических частиц вещества, находящихся в газе во взвешенном состоянии. Это явление в 1827 году впервые наблюдал Р. Броун, от имени которого оно получило название. Беспорядочность перемещения таких частиц объясняется случайным характером передачи импульсов от молекул газа частице с разных сторон. Броуновское движение оказывается тем заметнее, чем меньше частица и чем выше температура системы. Зависимость от температуры свидетельствует о том, что скорость хаотического движения молекул возрастает с увеличением температуры, именно поэтому его и называют тепловым движением.
Закон Авогадро[править | править код]
Закон Авогадро — одинаковые объёмы любых газов при одинаковом давлении и температуре содержат одинаковое число молекул.
Этот закон был открыт на основе опытов по химии итальянским учёным Амедео Авогадро в 1811 году. Закон касается слабо сжатых газов (например, газов под атмосферным давлением). В случае сильно сжатых газов считать его справедливым нельзя. Закон Авогадро означает, что давление газа при определённой температуре зависит только от числа молекул в единице объёма газа, но не зависит от того, какие это молекулы.
Количество вещества, содержащее число граммов, равное его молекулярной массе, называется грамм-молекулой или молем. Из сказанного следует, что моли разных веществ содержат одинаковое число молекул. Число молекул в одном моле вещества, получившее название «число Авогадро», является важной физической величиной. По ГОСТ 3651.2-97, значение постоянной Авогадро принимается:
- NA = 6,0221367 · 1023 ± 0,0000036 · 1023 моль−1
Число Авогадро, по данным CODATA−2010, равно
- NA = 6,02214129 · 1023 ± 0,00000027 · 1023 моль−1
Для определения постоянной Авогадро были сделаны многочисленные и разнообразные исследования (броуновского движения, явлений электролиза и др.), которые привели к достаточно согласованным результатам и являются ярким свидетельством реальности молекул и молекулярного строения вещества.
Кинетическая теория[править | править код]
Кинетическая теория даёт представление о макроскопических свойствах газов, рассматривая их молекулярное строение и движение молекул. Начиная с определения импульса и кинетической энергии, можно, используя закон сохранения импульса и геометрические зависимости, связать макроскопические свойства системы (температуру и давление) с микроскопическими свойствами (кинетической энергии одной молекулы).
Кинетическая теория объясняет термодинамические явления, исходя из атомистических представлений. Теория постулирует, что тепло является следствием хаотического движения чрезвычайно большого количества микроскопических частиц (атомов и молекул). Теория объясняет, как газовая система реагирует на внешние воздействия. Например, когда газ нагревается от абсолютного нуля, при котором его (классические) частицы абсолютно неподвижны, скорость частиц возрастает с ростом его температуры. Это приводит к большему числу их столкновений со стенками сосуда в единицу времени за счёт более высокой скорости. По мере роста числа столкновений возрастает их воздействие на стенки сосуда, пропорционально которому возрастает давление.
Успешное объяснение газовых законов, исходя из положений кинетической теории, стало одним из факторов подтверждения атомарного строения веществ в природе. В современной физике молекулярно-кинетическая теория рассматривается как составная часть статистической механики.
Электрический ток в газах[править | править код]
Газы — очень плохие проводники, но в ионизированном состоянии газ способен проводить электрический ток[6]. Проводимость газа зависит от напряжения нелинейно, поскольку степень ионизации изменяется по сложному закону. Основных способов ионизации газа два: термическая ионизация и ионизация электрическим разрядом. Кроме того, существует так называемый самостоятельный электрический разряд (пример — молния).
Термическая ионизация — придание атомам достаточной кинетической энергии для отрыва электрона от ядра и последующей ионизации вследствие повышения температуры газа и тепловое движение атомов газа, приводящее к столкновениям и превращением их в кинетическую энергию. Температуры, необходимые для ионизации газов, очень высоки (например, для водорода этот показатель составляет 6000 К). Этот тип ионизации газов распространён преимущественно в природе.
При низкой температуре газ также может проводить ток, если мощность его внутреннего электрического поля превышает некоторое пороговое значение. Пороговое значение в этом случае — достижение электроном под действием электрического поля достаточной кинетической энергии, необходимой для ионизации атома. Далее электроны снова разгоняются электрическим полем для ионизации и ионизируют два атома и т. д. — процесс становится цепным. В конечном итоге все свободные электроны достигнут позитивного электрода, позитивные ионы — негативного электрода. Данный тип ионизации распространён преимущественно в промышленности.
При нагревании катода электрическим разрядом с большой силой тока происходит его нагрев до степени термоэлектронной эмиссии электронов из него (дуговой разряд).
Процессы переноса[править | править код]
Для газа характерен высокий коэффициент самодиффузии.
Газы имеют невысокую теплопроводность, поскольку передача энергии от молекулы к молекуле происходит за счет редких столкновений. Этим объясняются хорошие теплоизоляционные свойства шерсти и ваты, материалов, в которых большинство объёма заполнено воздухом. Но в газах действует другой механизм передачи тепла — конвекция.
Сжимаемость[править | править код]
Сжимаемость (z) — это отношение удельного объёма газа к удельному объёму идеального газа с такой же молярной массой. Как правило, это число чуть меньше единицы, при этом наиболее значительно отклоняется от неё вблизи линии насыщения и для достаточно сложных органических газов, например, для метана при стандартных условиях z=0,9981{\displaystyle z=0,9981}[7].
Рассчитать коэффициент сжимаемости можно несколькими способами:
- модифицированным методом NX19 мод;
- модифицированным уравнением состояния GERG-91 мод;
- уравнением состояния AGA8-92DC;
- уравнением состояния ВНИЦ СМВ.
Теплоёмкость[править | править код]
Теплоёмкость газа сильно зависит от характера процесса, который с ним протекает. Наиболее часто используются изобарная теплоёмкость cp{\displaystyle c_{p}} и изохорная cv{\displaystyle c_{v}}; для идеального газа cp=cv+R{\displaystyle c_{p}=c_{v}+R}.
Теплопроводность[править | править код]
Теплопроводность газов — явление направленного переноса тепловой энергии за счёт столкновения частиц газа без переноса вещества.
Вязкость[править | править код]
В отличие от жидкостей, кинематическая вязкость газов с ростом температуры растёт, хотя для динамической вязкости зависимость менее выражена. Также вязкость растёт с давлением.
Число Прандтля[править | править код]
Число Прандтля (отношение кинематической вязкости к температуропроводности) Pr=νa=μcpλ{\displaystyle \mathrm {Pr} ={\nu \over a}={\mu c_{p} \over \lambda }} для газов обычно немного меньше единицы.
Под уравнением состояния (для газов) подразумевают математическую модель, которая используется для приближённого описания или моделирования свойств газа. В настоящее время не существует единого уравнения состояния, которое бы точно прогнозировало свойства всех газов при любых условиях. Поэтому было разработано большое число точных уравнений состояния для конкретных газов в диапазоне определённых температур и давлений. Математические модели газа, наиболее часто используемые — это модели «идеального газа» и «реального газа».
Идеальный газ[править | править код]
Идеальный газ — это газ, в котором молекулы можно считать материальными точками, а силами притяжения и отталкивания между молекулами можно пренебречь. В природе такого газа не существует, но близкими по свойствам к идеальному газу являются реальные разреженные газы при давлениях, не превышающих 200 атмосфер, и не очень низких температурах, поскольку при таких условиях расстояние между молекулами намного превышает их размеры. С точки зрения феноменологической термодинамики идеальным газом (по определению) называется гипотетический, не существующий в природе, газ, в точности подчиняющийся уравнению газового состояния Клапейрона — Менделеева: PV=νRT{\displaystyle PV=\nu \,RT}
Различают три типа идеального газа:
- Классический идеальный газ или газ Максвелла — Больцмана.
- Идеальный квантовый газ Бозе (состоит из бозонов).
- Идеальный квантовый газ Ферми (состоит из фермионов).
Внутренняя энергия идеального газа описывается следующим уравнением:
- U=c^VnRT=c^VNkT,{\displaystyle U={\hat {c}}_{V}nRT={\hat {c}}_{V}NkT,}
где
- c^V{\displaystyle {\hat {c}}_{V}} является константой (равной, например, 3/2 для одноатомного газа),
- U{\displaystyle U} — внутренняя энергия (Дж),
- P{\displaystyle P} — давление (Па),
- V{\displaystyle V} — объём (м3),
- n{\displaystyle n} — количество вещества (моль),
- R{\displaystyle R} — универсальная газовая постоянная (Дж/(моль·К)),
- T{\displaystyle T} — абсолютная температура (К),
- N{\displaystyle N} — количество молекул,
- k{\displaystyle k} — постоянная Больцмана (Дж/К).
Реальный газ[править | править код]
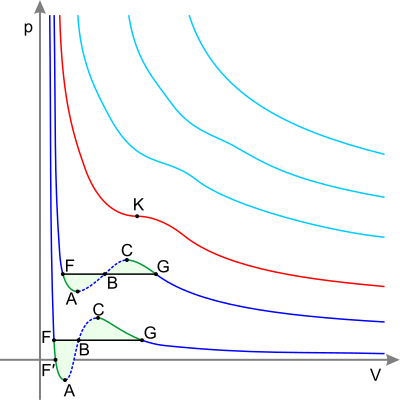
Реальный газ — это газ, между молекулами которого действуют силы межмолекулярного взаимодействия.
Опыт показал, что законы идеальных газов с высокой степенью точности справедливы для реальных газов лишь при температурах, превышающих критическую. При повышении давления и понижении температуры ниже критической обнаруживаются значительные отклонения в поведении всех реальных газов. Реальный газ имеет сжимаемость от внешних сил значительно меньшую, чем идеальный. Реальные газы конденсируются, а уравнение состояния идеального газа не может объяснить переход вещества из газообразного состояния в жидкое[8].
Силы межмолекулярного взаимодействия — короткодействующие, то есть проявляются на расстояниях R ≤ 10−9 м и быстро уменьшаются с увеличением расстояния.
Силы межмолекулярного взаимодействия в зависимости от расстояния между молекулами могут быть силами притяжения или силами отталкивания. Молекулярные силы притяжения называют силами Ван-дер-Ваальса. Из рисунка видно, что для больших расстояний между молекулами, когда плотность газа мала, силы Ван-дер-Ваальса правильно передают характер взаимодействия между молекулами. Части кривой, соответствующей межмолекулярному отталкиванию, в модели Ван-дер-Ваальса соответствует положительная часть кривой. На этом участке U (r) → ∞ при r ≤ d, то есть центры молекул не могут приблизиться на расстояние r < d (d — диаметр молекулы). В общем, изображена пунктиром кривая представляет потенциальную энергию парного взаимодействия молекул, между которыми действуют силы притяжения, а силы отталкивания проявляются лишь в случае столкновения согласно модели твердых шариков.
В 1873 году Ван-дер-Ваальс, проанализировав причины отклонения свойств реальных газов от закона Бойля-Мариотта, вывел уравнение состояния реального газа, в котором были учтены собственный объём молекул и силы взаимодействия между ними. Аналитическое выражение уравнение Ван-дер-Ваальса для одного моля газа имеет вид:
- (p+aVμ2)(Vμ−b)=RT{\displaystyle \left(p+{\frac {a}{V_{\mu }^{2}}}\right)\left(V_{\mu }-b\right)=RT},
где коэффициенты a{\displaystyle a} и b{\displaystyle b} называют постоянными Ван дер Ваальса, которые зависят от химической природы вещества, температуры и давления.
Уравнение Ван дер Ваальса для произвольного количества газа массой m{\displaystyle m} имеет вид:
- (p+m2μ2aV2)(V−mμb)=mμRT{\displaystyle \left(p+{\frac {m^{2}}{\mu ^{2}}}{\frac {a}{V^{2}}}\right)\left(V-{\frac {m}{\mu }}b\right)={\frac {m}{\mu }}RT}
Уравнение Ван-дер-Ваальса является приближенным уравнением состояния реального газа, причем степень его приближения различна для разных газов. Записано большое количество эмпирических и полуэмпирических уравнений состояния реальных газов (уравнение: Бертло, Клаузиуса — Клапейрона, Дитеричи, Редлиха — Квонг, Камерлинг-Оннес т. п.). За счет увеличения числа констант в этих уравнениях можно достичь лучшего согласования с практикой, по сравнению с уравнением Ван-дер-Ваальса. Однако уравнение Ван-дер-Ваальса, благодаря своей простоте и физическому содержанию постоянных a{\displaystyle a} и b{\displaystyle b} входящих в него, является самым распространённым для анализа качественной поведения реальных газов.
- ↑ Физическая Энциклопедия т. 1, 1988, с. 375.
- ↑ Белоконь Н. И., Основные принципы термодинамики, 1968, с. 78.
- ↑ Кириллин В. А. , Техническая термодинамика, 1983, с. 165.
- ↑ Перельман Я. И. ,Занимательная физика, 1994, с. 109.
- ↑ Физическая Энциклопедия т. 1, 1988, с. 123.
- ↑ Элементарный учебник ;физики / Под ред. Ландсберг Г. С.. — Изд. 8-е. — М.: Наука, 1972. — Т. 2. — С. 230—268.
- ↑ ГОСТ 30319.1-96. Газ природный. Методы расчета физических свойств. Определение физических свойств природного газа, его компонентов и продуктов его переработки.
- ↑ Вукалович М. П., Техническая термодинамика, 1968, с. 190—192.
- Физическая Энциклопедия / Гл. ред. А. М. Прохоров. — М.: Советская Энциклопедия, 1988. — Т. 1. — 704 с.
- Белоконь Н. И. Основные принципы термодинамики. — М.: Недра, 1968. — 112 с.
- Вукалович М. П. Техническая термодинамика. — М.: Энергия, 1968. — 496 с.
- Перельман Я. И. Занимательная физика. — Чебоксары: ТОО Арта, 1994. — Т. 2. — 272 с..
- Кириллин В. А. Техническая термодинамика. — 4-е. — М.: Энергоатомиздат, 1983. — 416 с.
| Название | Формула | Температура кипения, °C | Температура плавления, °C | Примечания |
|---|---|---|---|---|
| Гелий-4 | 4He | −268.928 | не затвердевает при обычном давлении | |
| Водород | H2 | −252.879 | −259.16 | есть орто- и пара-формы с разными температурами кипения |
| Неон | Ne | −246.046 | −248.59 | |
| Азот | N2 | −195.795 | −210.0 | |
| Угарный газ | CO | −191.5 | −205.02 | |
| Фтор | F2 | −188.11 | −219.67 | |
| Аргон | Ar | −185.848 | −189.34 | |
| Кислород | O2 | −182.962 | −218.79 | |
| Метан | CH4 | −182.5 | −164.00 | |
| Криптон | Kr | −153.415 | −157.37 | |
| Оксид азота(II) | NO | −151.74 | −163.6 | |
| Дифторид кислорода | F2O | −144.3 | −223.8 | |
| Трифторид азота | NF3 | −128.74 | −206.79 | |
| Тетрафторметан[1] | CF4 | −128,0 | −183.6 | |
| Моносилан[2] | SiH4 | −111.9 | −185 | |
| транс-Дифтордиазин | N2F2 | −111.45 | −172 | |
| Озон | O3 | −111.35 | −193 | |
| Ксенон | Xe | −108.099 | −111.75 | |
| цис-Дифтордиазин | N2F2 | −105.75 | ||
| этилен | CH2=CH2 | −103.7 | −169.2 | |
| Фторид фосфора(III) | PF3 | −101.8 | −151.5 | |
| Фторид хлора(I) | ClF | −101.1 | −155.6 | |
| Трифторид бора | BF3 | −99.9 | −126.8 | |
| Фторсилан | SiH3F | −98.6 | ||
| Трифторсилан | SiHF3 | −95 | −131 | |
| Трифторметилгипофторит[3] | CF3OF | −95 | ||
| Оксид азота(I) (Веселящий газ) | N2O | −88,48 | −90,86 | |
| Фосфин | PH3 | −87,75 | −133,8 | |
| Трифторид-оксид азота | NOF3 | −87,5 | −161 | |
| Тетрафторсилан | SiF4 | −86 | −90,2 | |
| 1,1-Дифторэтилен | CF2=CH2 | −85,5 | −144 | |
| Хлороводород | HCl | −85 | −114,17 | |
| Азидотрифторметан[4] | CF3N3 | −85 | −152 | |
| Фторид фосфора(V) | PF5 | −84,6 | −93,8 | |
| Карбонилфторид | COF2 | −84,5 | −111,2 | |
| Нитрозотрифторметан (трифторнитрозометан)[5] | CF3NO | −84 | −196,6 | |
| Трифторметан[1] | CHF3 | −82,2 | −155,15 | |
| Трифторхлорметан[1] | CClF3 | −81,5 | −181,0 | |
| Диоксид углерода | CO2 | −78,46 | сублимирует | |
| Фторметан[6] | CH3F | −78,4 | −137,8 | |
| Гексафторэтан[7] | CF3CF3 | −78,1 | −100 | |
| Пентафторметиламин[8] | CF3NF2 | −78 | −130 | |
| Дифторсилан | SiH2F2 | −77,8 | −122 | |
| Тетрафторэтилен | CF2=CF2 | −76 | −131,14 | |
| Фторацетилен[9] | FCCH | −74 | −196 | |
| Тетрафторгидразин | N2F4 | −74 | −164,5 | |
| Фторид нитрила | NO2F | −72,4 | −166 | |
| Фторэтилен[10] | CH2=CHF | −72 | −160,5 | |
| Трифторхлорсилан[11] | SiClF3 | −70 | −138 | |
| Трифторацетонитрил[5] | CF3CN | −68,8 | ||
| Дифторхлорамин[12] | NClF2 | −67 | −195 | |
| Бромоводород | HBr | −66,38 | −86,80 | |
| Бис(фторокси)дифторметан[3] | CF2(OF)2 | −64 | ||
| Гексафторид серы (элегаз)[13] | SF6 | −63,8 | сублимирует | |
| Арсин | AsH3 | −62,5 | −166 | |
| Радон | Rn | −61,7 | −71 | |
| Пентафтор-O-метилгидроксиламин[14] | CF3ONF2 | −60 | экстраполяция | |
| Фторид нитрозила | NOF | −59,9 | −132,5 | |
| Сероводород | H2S | −59,55 | −85,5 | |
| Трифторацетилфторид[15] | CF3COF | −59 | −159,5 | |
| Гексафтордиметиловый эфир[15] | CF3OCF3 | −59 | ||
| Бромтрифторметан[1] | CF3Br | −57,75 | −167,78 | |
| Метилсилан | CH3SiH3 | −57,5 | −156,5 | |
| Диоксидифторид | O2F2 | −57 | −163,5 | кипит с разложением на кислород и фтор |
| Сульфурилфторид | SO2F2 | −55,4 | −135,8 | |
| Фтордихлорсилан | SiHCl2F | −54,3 | ||
| Транс-1,2-дифторэтилен[16] | CHF=CHF | −53,1 | ||
| Трифторэтилен[10] | CF2=CHF | −53 | ||
| Пентафторид мышьяка | AsF5 | −52,8 | −79,8 | |
| Сульфид-трифторид фосфора | PSF3 | −52,25 | −148,8 | |
| Дифторметан (фреон-32) | CH2F2 | −52 | −136 | |
| Дифторкарбамоилфторид | F2NCOF | −52 | −152,2 | |
| Пентафторэтилгипофторит (пентафторфтороксиэтан)[3] | C2F5OF | −52 | −136 | |
| Станнан | SnH4 | −51,8 | −146 | |
| Тетрафторпропин | CF3C≡CF | −50,39 | ||
| Оксид-сульфид углерода (карбонилсульфид) | COS | −50,2 | −138,8 | |
| Кетен | CH2=C=O | −49,7 | −151 | |
| Оксид-тетрафторид серы(VI) | SOF4 | −48,5 | −99,6 | |
| Пентафторэтан | CF3CHF2 | −48,5 | −99,6 | |
| 3,3,3-Трифторпропин | CF3C≡CH | −48,1 | −100,6 | |
| Пропен | CH3CH=CH2 | −47,6 | −185,2 | |
| Дифторид-хлорид фосфора(III) | PClF2 | −47,3 | −164,8 | |
| Оксид-фторид-хлорид углерода | COClF | −47,2 | −148 | |
| 1,1,1-Трифторэтан | CH3CF3 | −47 | −111,8 | |
| Трифторметилгипохлорит | CF3OCl | −47 | −164 | |
| Перхлорилфторид | ClO3F | −46,75 | −147 | |
| Гексафторид селена | SeF6 | −46,6 | сублимирует | |
| Фторциан | FCN | −46 | −82 | |
| Нитрат фтора | FNO3 | −46 | −175 | |
| Нитрозопентафторэтан | C2F5NO | −45,7 | ||
| Цис-1,2-дифторэтилен | FCH=CHF | −45 | ||
| 1,1-Дифторпропен | CH3CH=CF2 | −44 | ||
| Трифторметил(фтор)силан | CF3SiH2F | −44 | ||
| Тионилфторид | SOF2 | −43,8 | −110,5 | |
| Тетрафторид-хлорид фосфора(V) | PF4Cl | −43,4 | −132 | |
| Метилдиборан | CH3B2H5 | −43 | ||
| Трифторметилдифторфосфин | CF3PF2 | −43 | ||
| N,N,1,1-Тетрафторметиламин | CHF2NF2 | −43 | ||
| Пропан | C3H8 | −42,25 | −187,7 | |
| Трифторметилтрифторсилан | CF3SiF3 | −42 | ||
| Бромтрифторсилан | SiF3Br | −41,7 | −70,5 | |
| Селеноводород | H2Se | −41,25 | −65,73 | |
| Дифторхлорметан | CHF2Cl | −40,7 | −175,42 | |
| Тетрафторид серы | SF4 | −40,45 | −125 | |
| Цис-гексафтордиазометан | CF3NNCF3 | −40 | −127 | |
| Оксид-трифторид фосфора | POF3 | −39,7 | Сублимирует | |
| Пентафторхлорэтан | CF3CF2Cl | −39,1 | −99 | |
| Трифторметилтетрафторфосфоран | CF3PF4 | −39 | −113 | |
| Гексафторид теллура | TeF6 | −38,9 | Сублимирует | |
| Винилдифторборан | CH2=CHBF2 | −38,8 | −133,4 | |
| (Трифторметил)силан | CF3SiH3 | −38,3 | −124 | |
| Гептафторэтиламин | CF3CF2NF2 | −38,1 | −183 | |
| Тетрафтораллен | CF2=C=CF2 | −38 | ||
| Гексафтороксетан | C3F6O | −38 | ||
| Трифторметантиол | CF3SH | −37,99 | −157,11 | |
| Фторэтан | CH3CH2F | −37,7 | −143,2 | |
| Бис(трифторметил)пероксид | CF3OOCF3 | −37 | ||
| Пентафторпропионитрил | CF3CF2CN | −37 | ||
| Гептафтордиметиламин | (CF3)2NF | −37 | ||
| Октафторпропан | CF3CF2CF3 | −36,8 | −147,7 | |
| Тетрафторид германия | GeF4 | −36,5 | ||
| Циклопропен | C3H4 | −36 | ||
| Трифторметилфторформиат | CF3C(O)F | −36 | −120 | |
| Трифторметилизоцианат | CF3NCO | −36 | ||
| Тетрафтор-1,2-диазетидин | C2F4N2H2 | −36 | ||
| Иодоводород | HI | −35,5 | −50,76 | |
| Гипофторит-пентафторид серы(VI) | SOF6 | −35,1 | −86 | |
| Трифторметил дифторметиловый эфир | CF3OCHF2 | −35,0 | −157 | |
| Пропадиен (Аллен) | CH2=C=CH2 | −34,8 | −136 | |
| Хлор | Cl2 | −34,04 | −101,5 | |
| Трифторметилфторформиат | FCOOCF3 | −34 | ||
| Тетрафтордиборан | B2F4 | −34 | −56 | |
| Аммиак | NH3 | −33,33 | −77,73 | |
| Нитротрифторметан | CF3NO2 | −32 | ||
| Дифтордихлорсилан | SiCl2F2 | −32 | −44 | |
| Дифтораминодифторацетонитрил | F2NCF2CN | −32 | ||
| Дифторметилен-бис-дифторамин | CF2(NF2)2 | −31,9 | −161,9 | |
| Транс-гексафтордиазометан | CF3NNCF3 | −31,1 | ||
| Циклопропан | C3H6 | −31 | −127,6 | |
| Монохлорсилан | SiHCl3 | −30,4 | −118 | |
| Гексафторпропилен | CF3CF=CF2 | −30,2 | −156,6 | |
| Хлорацетилен | CH≡CCl | −30 | −126 | |
| Метилтрифторсилан | CH3SiF3 | −30 | −73 | |
| Дифтордихлорметан | CCl2F2 | −29,8 | −157,7 | |
| Тетрафтордиазиридин | CF4N2 | −29 | ||
| Селена(VI) гипофторит-пентафторид | SeF5OF | −29 | ||
| Тетрафтороксетан | C2F4O | −28,6 | −117 | |
| Трифторхлорэтилен | C2F3Cl | −28,3 | −158,14 | |
| 2,3,3,3-Тетрафторпропен | CF3CF=CH2 | −28,3 | −152,2 | |
| Метилдифторфосфин | CH3PF2 | −28 | −110 | |
| Гексафторацетон | CF3COCF3 | −27,4 | −125,45 | |
| Трифтор(трифторметил)оксиран | CF3C2F3O | −27,4 | ||
| Тиазилтрифторид | N≡SF3 | −27,1 | −72,6 | |
| Трифторацетилхлорид | CF3COCl | −27 | −146 | |
| 3,3,3-Трифторпропен | CF3CH=CH2 | −27 | ||
| Формилфторид | HCOF | −26,5 | −142,2 | |
| 1,1,1,2-Тетрафторэтан | CF3CH2F | −26,1 | −103,3 | |
| Перфторметилвиниловый эфир | CF3OCF=CF2 | −26 | ||
| Метилтрифторметиловый эфир | CF3OCH3 | −25,2 | −149,1 | |
| Бис(трифторметил)нитроксил | (CF3)2NO | −25 | −70 | |
| Дифторхлорметилгипофторит[3] | CClF2OF | −25 | ||
| Серы(VI) пентафторид-цианид | SF5CN | −25 | −107 | |
| Диметиловый эфир | CH3OCH3 | −24,8 | −141,49 | |
| Оксид серы(IV) (Сернистый газ) | SO2 | −10,01 | −75,5 | |
| Фтордихлорметилгипофторит[3] | CFCl2OF | 0 | ||
| Гептафторид иода | IF7 | +4,8 | ||
| Фосген | COCl2 | +8.3 | −118 | |
| 2-Фторбутан | CH3CHFCH2CH3 | +25 | −121 |
Монооксид углерода — Википедия
| Монооксид углерода | |||
|---|---|---|---|
| |||
| Систематическое наименование | Монооксид углерода | ||
| Хим. формула | CO | ||
| Рац. формула | CO | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 28,01 г/моль | ||
| Плотность | 0,001250°C; 0,814-195°C г/см³ | ||
| Энергия ионизации | 14,01 ± 0,01 эВ[2] | ||
| Температура | |||
| • плавления | −205 °C | ||
| • кипения | −191,5 °C | ||
| Пределы взрываемости | 12,5 ± 0,1 об.%[2] | ||
| Энтальпия | |||
| • образования | −110,52 кДж/моль | ||
| Давление пара | 35 ± 1 атм[2] | ||
| Растворимость | |||
| • в воде | 0,0026 г/100 мл | ||
| Рег. номер CAS | 630-08-0 | ||
| PubChem | 281 | ||
| Рег. номер EINECS | 211-128-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | FG3500000 | ||
| ChEBI | 17245 | ||
| Номер ООН | 1016 | ||
| ChemSpider | 275 | ||
| Токсичность | Высокотоксичен, СДЯВ | ||
| Пиктограммы ECB |    | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Моноокси́д углеро́да (уга́рный газ, о́кись углеро́да, оксид углерода(II)) — бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула — CO.
Молекула CO имеет тройную связь, как и молекула азота N2. Так как эти молекулы сходны по строению (изоэлектронны, двухатомны, имеют близкую молярную массу), то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой » :C≡O: «.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ2
Oσ2
zπ4
x, y σ2
C. Тройная связь образована σ-связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум π-связям. Электроны на несвязывающих σC-орбитали и σO-орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13 Å).
Молекула слабо поляризована, её электрический дипольный момент μ = 0,04⋅10−29 Кл·м. Многочисленные исследования показали, что отрицательный заряд в молекуле CO сосредоточен на атоме углерода C−←O+ (направление дипольного момента в молекуле противоположно предполагавшемуся ранее). Энергия ионизации 14,0 эВ, силовая константа связи k = 18,6.
Оксид углерода(II) представляет собой бесцветный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует оксид углерода(II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах. Так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже.
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830 °C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции
- h3O+CO⇄CO2+h3{\displaystyle {\mathsf {H_{2}O+CO\rightleftarrows CO_{2}+H_{2}}}}
до 830 °C смещено вправо, выше 830 °C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Оксид углерода(II) горит пламенем синего цвета[3] (температура начала реакции 700 °C) на воздухе:
- 2CO+O2→2CO2{\displaystyle {\mathsf {2CO+O_{2}\rightarrow 2CO_{2}}}} (ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/K).
Температура горения CO может достигать 2100 °C. Реакция горения является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления. В смеси с воздухом взрывоопасен; нижний и верхний концентрационные пределы распространения пламени: от 12,5 до 74 % (по объёму)[4].
Оксид углерода(II) реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
- CO+Cl2→hνCOCl2.{\displaystyle {\mathsf {CO+Cl_{2}{\xrightarrow {h\nu }}COCl_{2}}}.}
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида COF2, можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42 °C, кипения +16 °C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200 °C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
- (FCO)2O2+2KI→2KF+I2+2CO2.{\displaystyle {\mathsf {(FCO)_{2}O_{2}+2KI\rightarrow 2KF+I_{2}+2CO_{2}.}}}
Оксид углерода(II) реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
- CO+S→COS{\displaystyle {\mathsf {CO+S\rightarrow COS}}} (ΔG°298 = −229 кДж, ΔS°298 = −134 Дж/K).
Получены также аналогичные селеноксид углерода COSe и теллуроксид углерода COTe.
Восстанавливает SO2:
- 2CO+SO2→2CO2+S.{\displaystyle {\mathsf {2CO+SO_{2}\rightarrow 2CO_{2}+S.}}}
C переходными металлами образует горючие и ядовитые соединения — карбонилы, такие как [Fe(CO)5], [Cr(CO)6], [Ni(CO)4], [Mn2(CO)10], [Co2(CO)9] и др. Некоторые из них летучие.
- nCO+Me→[Me(CO)n]{\displaystyle {\mathsf {nCO+Me\rightarrow [Me(CO)_{n}]}}}
Оксид углерода(II) незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако реагирует с расплавами щелочей с образованием соответствующих формиатов:
- CO+KOH→HCOOK.{\displaystyle {\mathsf {CO+KOH\rightarrow HCOOK.}}}
Интересна реакция оксида углерода(II) с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
- 2K+2CO→K2C2O2.{\displaystyle {\mathsf {2K+2CO\rightarrow K_{2}C_{2}O_{2}.}}}
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (диоксид тория ThO2) по уравнению:
- CO+Nh4→h3O+HCN.{\displaystyle {\mathsf {CO+NH_{3}\rightarrow H_{2}O+HCN.}}}
Важнейшим свойством оксида углерода(II) является его способность реагировать с водородом с образованием органических соединений (процесс синтеза Фишера — Тропша):
- xCO+yh3→{\displaystyle {\mathsf {xCO+yH_{2}\rightarrow }}} спирты + линейные алканы.
Этот процесс является источником производства таких важнейших промышленных продуктов как метанол, синтетическое дизельное топливо, многоатомные спирты, масла и смазки.
Токсичность[править | править код]
Угарный газ очень токсичен.
TLV (предельная пороговая концентрация, США): 25 ppm; 29 мг/м³ (как TWA — среднесменная концентрация, США) (ACGIH 1994—1995). MAC (максимальная допустимая концентрация, США): 30 ppm; 33 мг/м³; Беременность: B (вредный эффект вероятен даже на уровне MAK) (1993). ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³ (около 0,0017 %).
В выхлопе бензинового автомобиля допускается до 1,5-3 % (допустимая концентрация сильно различается в зависимости от страны/применяемых стандартов; а 3% — много даже для старого карбюраторного автомобиля без катализатора).
По классификации ООН оксид углерода(II) относится к классу опасности 2,3, вторичная опасность по классификации ООН: 2,1.
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть.[5] Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, учащённое сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, потеря сознания, кома[6][3].
Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом (оксигемоглобином)[6]. Таким образом, блокируются процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0,1 % приводит к смерти в течение одного часа[6].
Опыты на молодых крысах показали, что концентрация CO в воздухе 0,02 % замедляет их рост и снижает активность по сравнению с контрольной группой.
Помощь при отравлении оксидом углерода(II)[править | править код]
Соединение окиси углерода с гемоглобином обратимо. При отравлении рекомендуются следующие действия[6]:
- Пострадавшего следует вынести на свежий воздух. При отравлении лёгкой степени достаточно гипервентиляции лёгких кислородом.
- Искусственная вентиляция лёгких, О2-терапия, в том числе в барокамере.
- Ацизол, хромосмон внутривенно.
Мировой медицине неизвестны надежные антидоты для применения в случае отравления угарным газом[7].
Защита от оксида углерода(II)[править | править код]
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух. Обычный способ защиты — использование изолирующего дыхательного аппарата[3].
Эндогенный монооксид углерода[править | править код]
Эндогенный монооксид углерода вырабатывается в норме клетками организма человека и животных и выполняет функцию сигнальной молекулы. Он играет известную физиологическую роль в организме, в частности, является нейротрансмиттером и вызывает вазодилатацию[8]. Ввиду роли эндогенного угарного газа в организме, нарушения его метаболизма связывают с различными заболеваниями, такими, как нейродегенеративные заболевания, атеросклероз кровеносных сосудов, гипертоническая болезнь, сердечная недостаточность, различные воспалительные процессы[8].
Эндогенный угарный газ образуется в организме благодаря окисляющему действию фермента гемоксигеназы на гем, являющийся продуктом разрушения гемоглобина и миоглобина, а также других гемосодержащих белков. Этот процесс вызывает образование в крови человека небольшого количества карбоксигемоглобина, даже если человек не курит и дышит не атмосферным воздухом (всегда содержащим небольшие количества экзогенного угарного газа), а чистым кислородом или смесью азота с кислородом.
Вслед за появившимися в 1993 году первыми данными о том, что эндогенный угарный газ является нормальным нейротрансмиттером в организме человека[9][10], а также одним из трёх эндогенных газов, которые в норме модулируют течение воспалительных реакций в организме (два других — оксид азота (II) и сероводород), эндогенный угарный газ привлёк значительное внимание клиницистов и исследователей как важный биологический регулятор. Было показано, что во многих тканях все три вышеупомянутых газа являются противовоспалительными веществами, вазодилататорами, а также вызывают ангиогенез[11]. Однако не всё так просто и однозначно. Ангиогенез — не всегда полезный эффект, поскольку он, в частности, играет роль в росте злокачественных опухолей, а также является одной из причин повреждения сетчатки при макулярной дегенерации. В частности, курение (основной источник угарного газа в крови, дающий в несколько раз большую концентрацию его, чем естественная продукция) повышает риск макулярной дегенерации сетчатки в 4-6 раз.
Существует теория о том, что в некоторых синапсах нервных клеток, где происходит долговременное запоминание информации, принимающая клетка в ответ на принятый сигнал вырабатывает эндогенный угарный газ, который передаёт сигнал обратно передающей клетке, чем сообщает ей о своей готовности и в дальнейшем принимать сигналы от неё и повышая активность клетки-передатчика сигнала. Некоторые из этих нервных клеток содержат гуанилатциклазу, фермент, который активируется при воздействии эндогенного угарного газа[10].
Исследования, посвящённые роли эндогенного угарного газа как противовоспалительного вещества и цитопротектора, проводились во множестве лабораторий по всему миру. Эти свойства эндогенного угарного газа делают воздействие на его метаболизм интересной терапевтической мишенью для лечения таких разных патологических состояний, как повреждение тканей, вызванное ишемией и последующей реперфузией (а это, например, инфаркт миокарда, ишемический инсульт), отторжение трансплантата, атеросклероз сосудов, тяжёлый сепсис, тяжёлая малярия, аутоиммунные заболевания. Проводились в том числе и клинические испытания на человеке, однако результаты их пока ещё не опубликованы[12].
На 2015 год о роли эндогенного угарного газа в организме известно следующее[13]:
- Эндогенный угарный газ — одна из важных эндогенных сигнальных молекул;
- Эндогенный угарный газ модулирует функции ЦНС и сердечно-сосудистой системы;
- Эндогенный угарный газ ингибирует агрегацию тромбоцитов и их адгезию к стенкам сосудов;
- Влияние на обмен эндогенного угарного газа в будущем может быть одной из важных терапевтических стратегий при ряде заболеваний.
Токсичность дыма, выделяющегося при горении угля, была описана ещё Аристотелем и Галеном.
Оксид углерода(II) был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем.
То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крюйкшенк. Токсичность газа была исследована в 1846 году французским медиком Клодом Бернаром в опытах на собаках[14].
Оксид углерода(II) вне атмосферы Земли впервые был обнаружен бельгийским учёным М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК-спектре Солнца. Оксид углерода(II) в межзвёздной среде был обнаружен в 1970 г.[15]
Промышленный способ[править | править код]
Влияние температуры на равновесие реакции: CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}}- 2C+O2→2CO{\displaystyle {\mathsf {2C+O_{2}\rightarrow 2CO}}} (тепловой эффект этой реакции 220 кДж),
- CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}} (ΔH = 172 кДж, ΔS = 176 Дж/К)
Эта реакция происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом оксид углерода(II) вследствие своей ядовитости вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ»[3].
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400 °C равновесие практически полностью сдвинуто влево, а при температуре выше 1000 °C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому оксид углерода(II) при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
Лабораторный способ[править | править код]
- HCOOH→h3SO4oth3O+CO.{\displaystyle {\mathsf {HCOOH{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}H_{2}O+CO.}}}
- Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
- HCOOH+ClSO3H→h3SO4+HCl+CO↑.{\displaystyle {\mathsf {HCOOH+ClSO_{3}H\rightarrow H_{2}SO_{4}+HCl+CO\uparrow .}}}
- h3C2O4→h3SO4otCO↑+CO2↑+h3O.{\displaystyle {\mathsf {H_{2}C_{2}O_{4}{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}CO\uparrow +CO_{2}\uparrow +H_{2}O.}}}
- K4[Fe(CN)6]+6h3SO4+6h3O→ot2K2SO4+FeSO4+3(Nh5)2SO4+6CO↑.{\displaystyle {\mathsf {K_{4}[Fe(CN)_{6}]+6H_{2}SO_{4}+6H_{2}O{\xrightarrow[{}]{^{o}t}}2K_{2}SO_{4}+FeSO_{4}+3(NH_{4})_{2}SO_{4}+6CO\uparrow .}}}
- Mg+ZnCO3→otMgO+ZnO+CO↑.{\displaystyle {\mathsf {Mg+ZnCO_{3}{\xrightarrow[{}]{^{o}t}}MgO+ZnO+CO\uparrow .}}}
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
- PdCl2+CO+h3O→Pd↓+CO2+2HCl.{\displaystyle {\mathsf {PdCl_{2}+CO+H_{2}O\rightarrow Pd\downarrow +CO_{2}+2HCl.}}}
Эта реакция очень чувствительная. Стандартный раствор: 1 грамм хлорида палладия на литр воды.
Количественное определение оксида углерода(II) основано на иодометрической реакции:


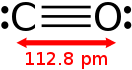
 (
(