Расщепление воды: Наука: Наука и техника: Lenta.ru
Расщепление воды с эффективностью 100%: полдела сделано / Хабр
Если найти дешёвый и простой способ электролиза/фотолиза воды, то мы получим невероятно богатый и чистый источник энергии — водородное топливо. Сгорая в кислороде, водород не образует никаких побочных выделений, кроме воды. Теоретически, электролиз — очень простой процесс: достаточно пропустить электрический ток через воду, и она разделяется на водород и кислород. Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Теперь учёные решили часть головоломки. Исследователи из Технион-Израильского технологического института разработали метод проведения второго из двух шагов окислительно-восстановительной реакции — восстановления — в видимом (солнечном) свете с энергетической эффективностью 100%, значительно превзойдя предыдущий рекорд 58,5%.
Осталось усовершенствовать полуреакцию окисления.
Столь высокой эффективности удалось добиться благодаря тому, что в процессе используется только энергия света.
В полуреакции окисления производятся четыре отдельных атома водорода и молекула О2 (которая не нужна). В полуреакции восстановления четыре атома водорода спариваются в две молекулы H2, производя полезную форму водорода — газ H2,
Эффективность 100% означает, что все фотоны, поступившие в систему, участвуют в генерации электронов.
На такой эффективности каждый наностержень генерирует около 100 молекул H2 в секунду.
Сейчас учёные работают над оптимизацией техпроцесса, который пока что требует щелочной среды с невероятно высоким pH. Такой уровень никак не приемлем для реальных условий эксплуатации.
К тому же, наностержни подвержены коррозии, что тоже не слишком хорошо.
Тем не менее, сегодня человечество стало на шажок ближе к получению неиссякаемого источника чистой энергии в виде водородного топлива.
Научная работа опубликована в журнале Nano Letters (зеркало).
Ученые научились получать водород из воды — Российская газета
Ученые Стэнфордского университета создали «расщепитель» воды, способный 24 часа в сутки и семь дней в неделю производить из воды водород и кислород. По словам ученых, это своего рода мировой рекорд. Но самое главное, что цена этого водорода намного ниже, чем у всех существующих сегодня электролизеров. Дело в том, что в них применяются дорогие катализаторы — как правило платина и иридий, на которых и протекает реакция электролиза. Кроме этого, электроды находятся в электролитах, разделенных дорогостоящей мембраной, обеспечивающей ионную электрическую проводимость. Словом высокая цена оставалась главным препятствием для водородной революции на транспорте, которую вот уже лет 20 обещают энтузиасты водорода.
Созданный американскими учеными намного дешевле, он сделан из оксида железа-никеля. Электролизер расщепляет воду при потенциале всего в 1,5 вольта, а его эффективность при комнатной температуре имеет беспрецедентное значение — 82 процента.
Ключом к созданию высокоэффективного и простого катализатора стали ионы лития, которые позволили «расколоть» слой оксида железа-никеля на очень мелкие частички. В итоге намного увеличилась площадь поверхности, на которой проходит реакция расщепления воды, и к тому же она стала более активной. «Кроме этого, частички оксида хорошо связаны друг с другом, что обеспечивает высокую электрическую проводимость электрода в целом», — говорит автор разработки профессор И Куи.
Водород уже давно считается одним из самых перспективных видов альтернативного топлива. Но методы получения водорода из воды путем электролиза до последнего времени были экономически не выгодны и, поэтому, не получили широкого распространения. Созданная в Стэнфорде технология может стать бесконечным источником экологически чистого водородного топлива для различных видов транспорта и для промышленных нужд. Профессор Куи уверен, что такие же принципы могут стать основой создания катализаторов, предназначенных для других реакций, нежели электрохимическое расщепление воды на водород и кислород.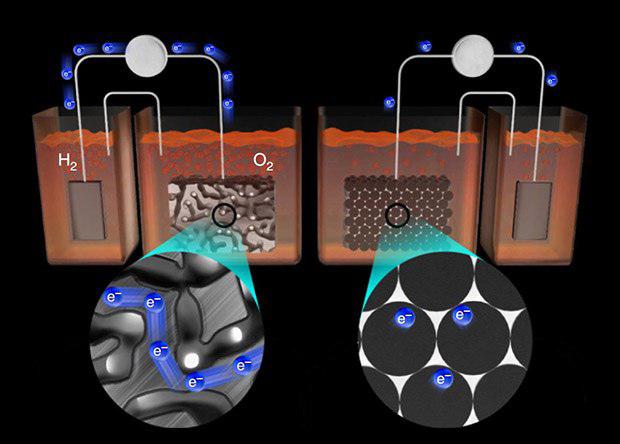
Удар для любителей нефти: два шага к новой энергетике
Сразу две исследовательские группы объявили о серьезных успехах на пути к искусственному фотосинтезу — процессу, при котором вода расщепляется солнечным светом с образованием водорода и кислорода. Водород и кислород при этом образуют эффективное и экологически чистое топливо: при их реакции образуется опять же вода. Немецкие исследователи разработали эффективный катализатор, обеспечивающий разложение воды. Тем временем ученые из британского Кембриджа предложили систему полуискусственного фотосинтеза с использованием отдельных элементов живых организмов.
Почти вся энергия, используемая человечеством, поступает к нам от Солнца (исключение — энергия распада урана, которая идет от другого источника — давно потухших звезд). Именно энергия Солнца заключена во всех видах ископаемого топлива: ее запасли для нас живые организмы прежних эпох.
Живая природа выработала исключительно эффективный способ использовать энергию Солнца — фотосинтез. Прилетевший от Солнца фотон растения и цианобактерии используют, чтобы разбить молекулу воды на кислород и водород. Кислород они тут же выбрасывают, а водород в конечном счете используют для того, чтобы обвешать им молекулу углекислого газа, превратив ее в органику. Эту самую органику, то есть энергию химических связей между углеродом и водородом, человечество и использует, сжигая ископаемое топливо или непосредственно части растений (например, древесину).
Прилетевший от Солнца фотон растения и цианобактерии используют, чтобы разбить молекулу воды на кислород и водород. Кислород они тут же выбрасывают, а водород в конечном счете используют для того, чтобы обвешать им молекулу углекислого газа, превратив ее в органику. Эту самую органику, то есть энергию химических связей между углеродом и водородом, человечество и использует, сжигая ископаемое топливо или непосредственно части растений (например, древесину).
Реклама на Forbes
Синтез органики из углекислого газа, воды и солнечного света — процесс, который удается растениям так хорошо, что людям нет никакого смысла его копировать: достаточно просто посадить побольше лесов. Однако инженеров очень привлекает другая возможность: если не доводить природный процесс до конца, а остановить его на стадии расщепления воды, можно запасать солнечную энергию в виде водорода и кислорода. Водород и кислород по отдельности выделяют многие микроорганизмы, но вот объединить эти процессы для обеспечения собственной энергетики живая природа не додумалась (она нашла для этого более изысканные и безопасные химические реакции). Между тем такой технологический процесс мог бы многократно покрыть все сегодняшние энергетические потребности человечества.
Между тем такой технологический процесс мог бы многократно покрыть все сегодняшние энергетические потребности человечества.
Йохен Фельдман и Яцек Столарчик из Мюнхена, а также Франк Вюртнер из Вюрцбурга решили важнейшую проблему: как эффективно разделить воду на водород и кислород и не дать им соединиться обратно. Их подход основан на довольно традиционной технологии использования полупроводников. После поглощения фотона в полупроводнике создается пара из электрона и положительно заряженной «дырки». Электрон используется для того, чтобы «восстановить» из воды водород. В прежних инженерных решениях «дырки» старались как можно быстрее удалить из полупроводника с помощью химических реагентов, и таким образом вторая, более медленная часть реакции — «окисление» кислорода «дыркой» — оставалась неосуществленной.
Зачем нам использовать наработки древних растений, если мы сами научимся делать то же, что и они, — только лучше?
Эту проблему и решили исследователи.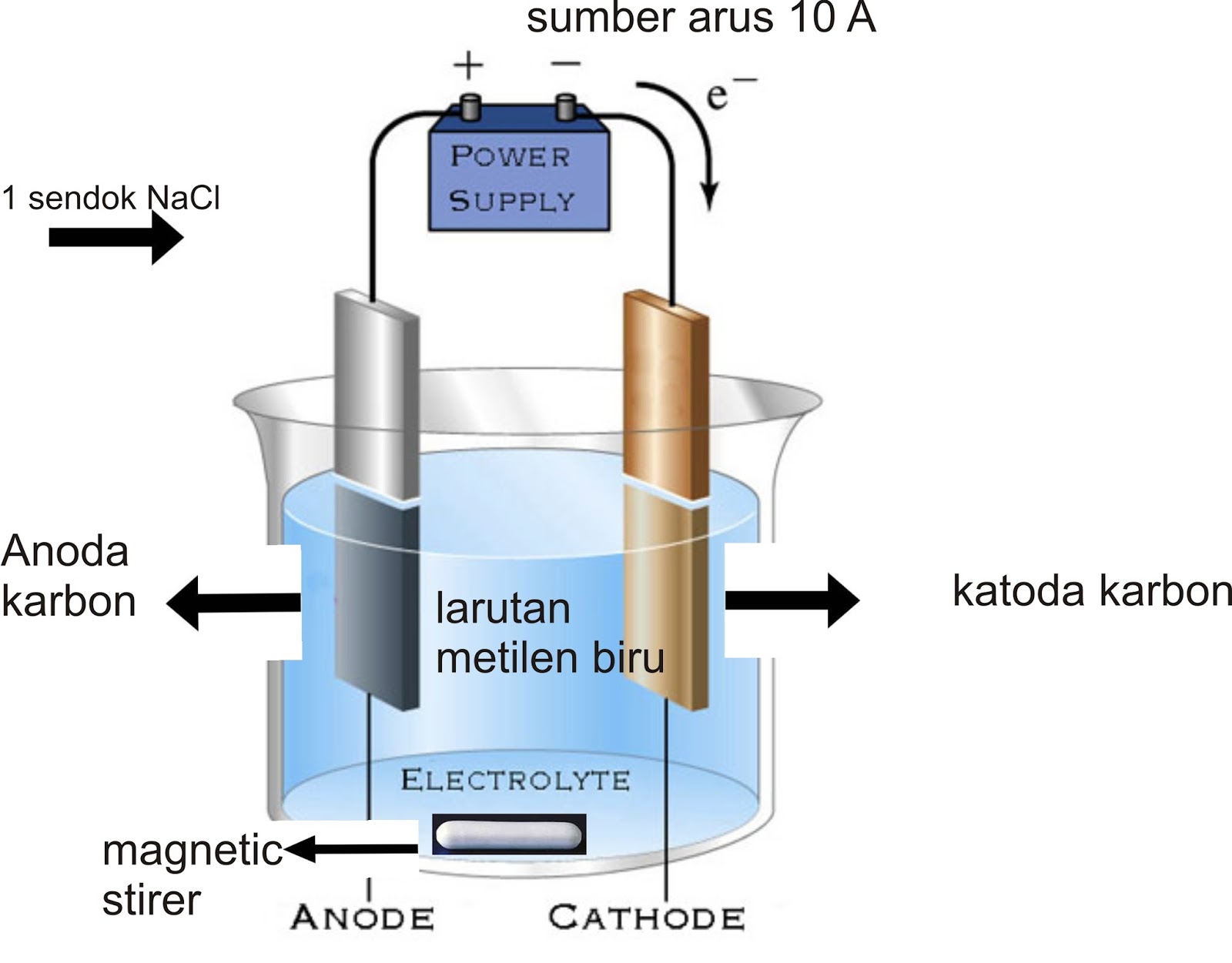
Ученые из Кембриджа придерживались другого подхода: они объединили в одном дизайне инженерные технологии человека и компоненты природных живых систем. Получившийся в результате процесс преподнес исследователям сюрприз: он позволил использовать энергию солнечного света даже более эффективно, чем это делает природный фотосинтез в растениях.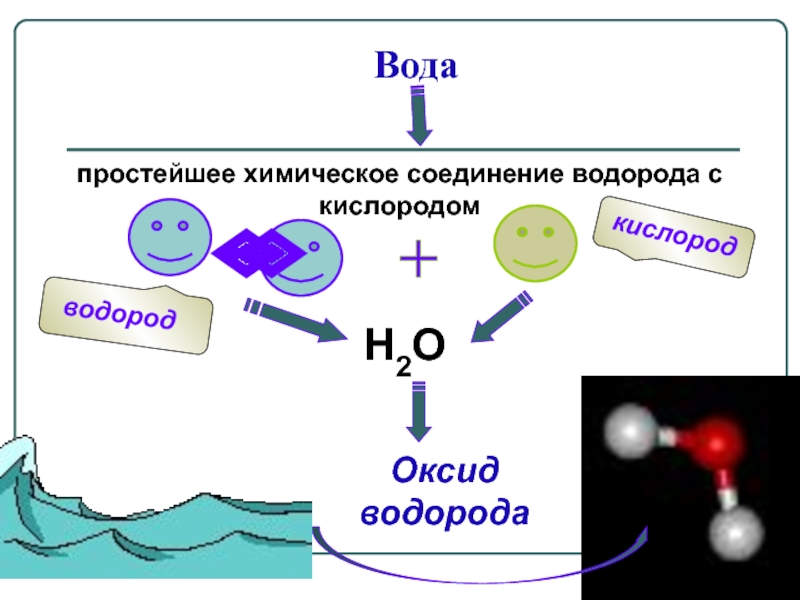
Преимущества полуискусственного фотосинтеза в том, что для него не нужны дорогие и токсичные катализаторы, ограничивающие возможности полностью искусственных систем, вроде описанной выше. С другой стороны, полуискусственные процессы, возможно, вскоре удастся масштабировать до промышленного уровня.
Авторы использовали молекулярное оборудование природной фотосистемы II, добавив к нему фермент гидрогеназу из водорослей, восстанавливающий протоны до водорода. В природном фотосинтезе ничего подобного не происходит, так как выделяющиеся при расщеплении воды протоны сразу же вовлекаются в другие биохимические процессы. Однако исследователям удалось совместить две биологические реакции, в обычных условиях разобщенные: работу фермента гидрогеназы и расщепление воды фотосистемой II. Оба «живых» компонента фиксировали на фотоаноде, покрытом особым красителем. В результате природный процесс был оптимизирован: вместо кислорода и восстановленной из СО 2 органики модифицированный фотосинтез стал давать просто кислород и водород — два вещества, на которых, возможно, будет базироваться «зеленая» энергетика будущего.
Появление на протяжении одной недели сразу двух научных работ, с разных сторон атакующих проблему искусственного фотосинтеза, свидетельствует, что этой технологии, возможно, нам не так уж долго ждать. О том, как это достижение изменит все без исключения промышленные технологии, пока можно только догадываться, но оно несомненно будет означать конец эры ископаемого топлива. Зачем нам использовать наработки древних растений, если мы сами научимся делать то же, что и они, — только лучше?
Расщепление воды — Справочник химика 21
В то же время обратная реакция — расщепление воды на водород и кислород — требует затраты энергии (тепловой или, лучше, электрической). Расщепление молекулы воды не является самопроизвольным в отсутствие энергии расщепление вообще не происходит, и уже начавшаяся реакция тотчас же прекратится, если подачу энергии прервать. Благодаря развитию в последние годы промышленности микробиологического синтеза ферменты стали более доступны. Это позволяет применять их не только в пищевой промышленности. Ферменты, катализирующие реакции расщепления водой белков, жиров и углеводов, в очень небольших количествах вво- дят в синтетические моющие средства, предназначен- ные для стирки, [c.113]
Это позволяет применять их не только в пищевой промышленности. Ферменты, катализирующие реакции расщепления водой белков, жиров и углеводов, в очень небольших количествах вво- дят в синтетические моющие средства, предназначен- ные для стирки, [c.113]
Напишите структурные формулы этиленовых углеводородов, озониды которых при расщеплении водой образуют [c.53]
Известно, что в ходе фотосинтеза растения используют воду и СО, для произ..,)дства углеводов и выделения кислорода. Процесс осуществляется в фотосинтезирующих структурах — хлоропластах, которые в свою очередь состоят из более мелких субклеточных структур — ламелл, В ламеллах при поглощении двух квантов света молекулами хлорофилла протекает реакция расщепления воды и СОг [c.342]
Для некоторых процессов в водных растворах вода является непосредственным участником реакции. Примером наиболее изученных реакций подобного типа является гидролиз ( расщепление водой ) этилацетата с образованием уксусной кислоты и этанола (этилового спирта [c.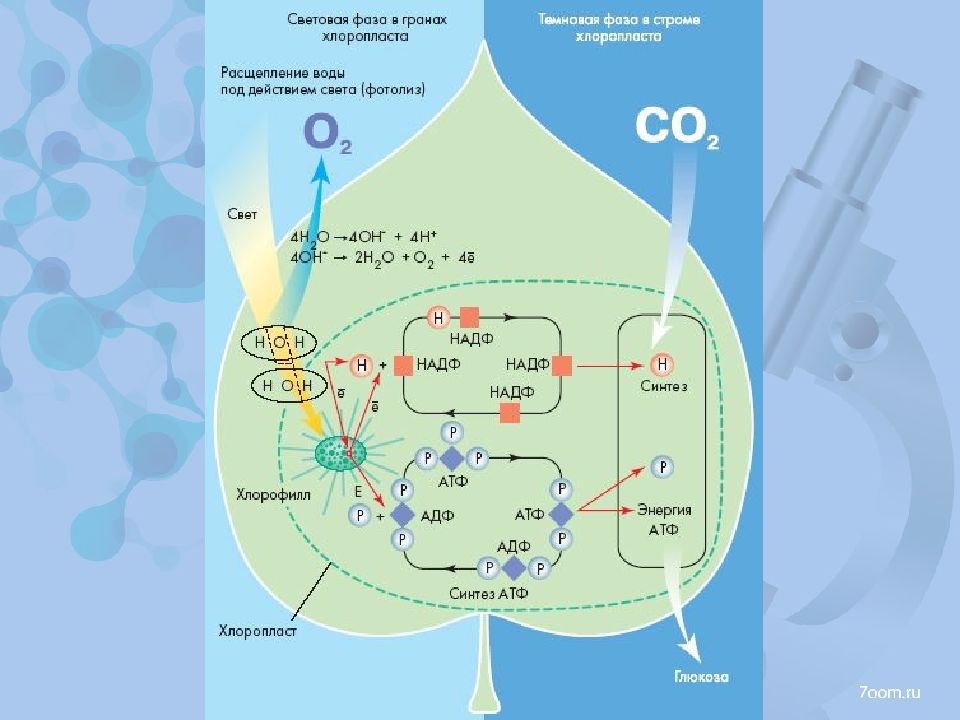 208]
208]
Из употребляемых для расщепления озонидов таких безводных растворителей, как спирт, эфир, безводные муравьиная и уксусная кислоты, лишь последняя оказалась особенно пригодной. В этой кислоте озонирование протекает очень равномерно, так как почти все озониды в ней растворимы и таким образом при ее употреблении eвoзмoжнo загрязнение образующегося озонида вследствие обволакивания им исходного материала. Однако для приготовления чистых озопидов ледяная уксусная кислота не особенно пригодна, так как требуется слишком высокая температура для ее полного удаления. Зто обстоятельство не имеет значения, когда озонид сразу расщепляется в самом растворе. Расщепление озонидов ледяной уксусной кислотой производится таким же образо.м, как и водой, т. е. простым нагреванием или продолжительным кипячением. При этом образуются перекпси в значительно большем количестве, чем при расщеплении водой, а при известных условиях имеют место даже все теоретически предусмотренные возможности.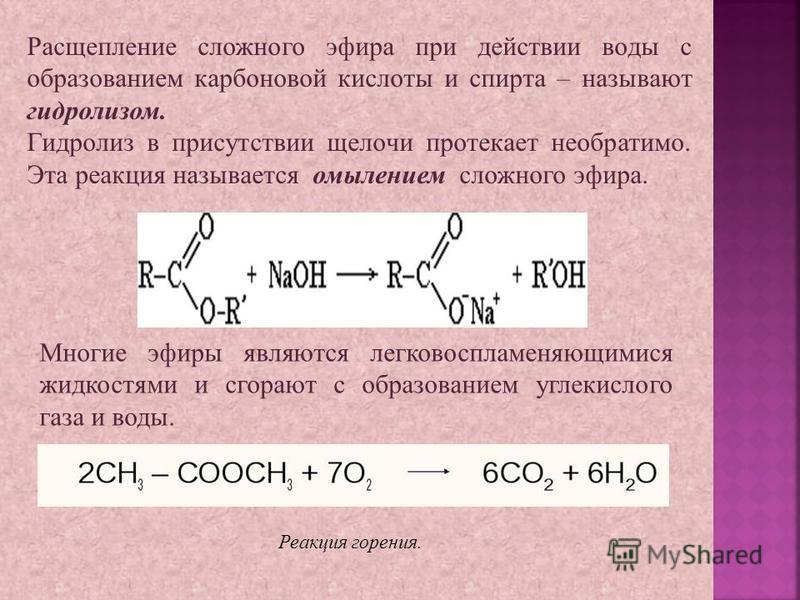 Так, озонид олеиновой кислоты распадается в ледяной уксусной кислоте следующим образом [c.86]
Так, озонид олеиновой кислоты распадается в ледяной уксусной кислоте следующим образом [c.86]
Поэтому не удивителен интерес, который проявляется к использованию тепла, выделяемого в атомном реакторе для химического расщепления воды. [c.68]
Бензин предваритель ного гидрирования Бензин расщепления Вода введенная. . . Вода реакции. . . Зола 4-катализатор. Пастообразователь Непрореагировавшая масса угля. … [c.230]
Из жиров путем расщепления водой получают свободные жирные кислоты [c.294]
Прямой фотолиз воды. не. подходит для преобразования солнечной энергии, поскольку вода не поглощает в видимом спектральном диапазоне. Энергетический порог расщепления БОДЫ до радикальных фрагментов И и ОН примерно соответствует длине волны света Я = 240 нм, но даже на этой длине волны свет поглощается слабо. В то же время ионный окислительно-восстановительный механизм требует переноса четырех электронов.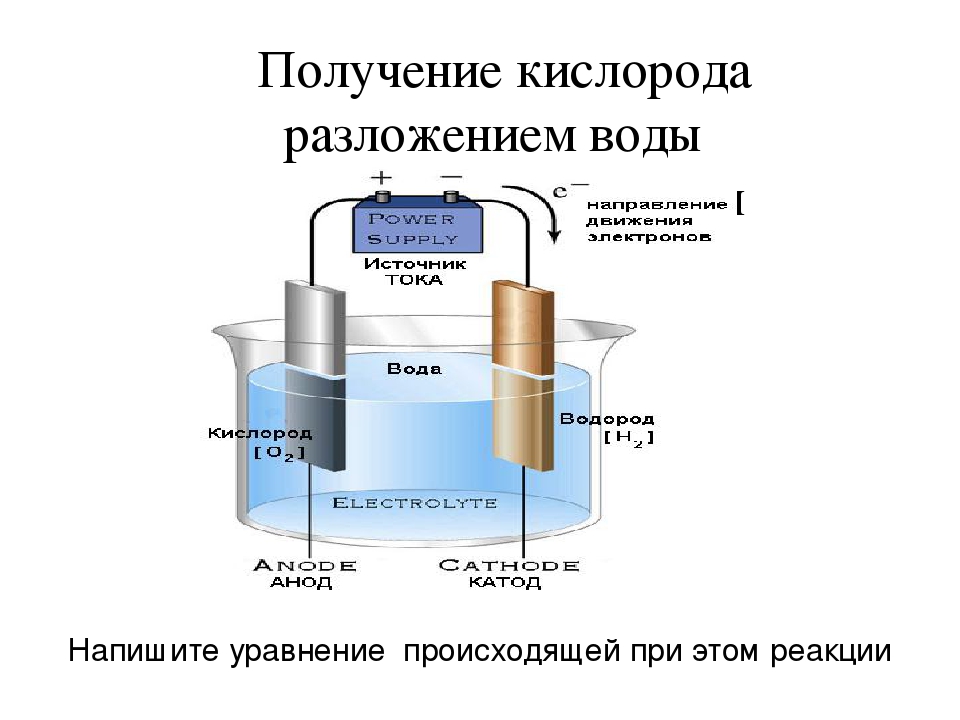 Для переноса каждого электрона необходима свободная энергия 472/4=118 кДж/моль, соответствующая энергии поглощаемого кванта света с длиной волны примерно 1000 нм в ближнем ИК-диапазоне (или, в терминах потенциала, около 118 000/96 500=1,22 В). Такое многоквантовое окислительновосстановительное расщепление воды представляется многообещающим. Вопрос заключается в том, как его осуществить. [c.268]
Для переноса каждого электрона необходима свободная энергия 472/4=118 кДж/моль, соответствующая энергии поглощаемого кванта света с длиной волны примерно 1000 нм в ближнем ИК-диапазоне (или, в терминах потенциала, около 118 000/96 500=1,22 В). Такое многоквантовое окислительновосстановительное расщепление воды представляется многообещающим. Вопрос заключается в том, как его осуществить. [c.268]
Напишите структурные формулы этиленовых углеводородов, озон иды которых при расщеплении водой образуют формальдегид и 2-метил-бута-наль. [c.41]
В этом случае п — степень полимеризации — удвоилось, а соотношения масс составляют приблизительно 10 137, т. е. количество металла ничтожно мало. Но и процессы химической деструкции не требуют больших масс реагентов. Рассмотрим расщепление водой макромолекулы полиамида в определенных условиях о Н I о Н о [c.512]
Донор электронов Y для фотосистемы I расположен в конце последовательности компонентов электронтранспортной цепи — после пластохинона, цитохрома / и пластоцианина. Он получает электроны, передающиеся через эти промежуточные компоненты, от соединения Q (окислительно-восстановительный потенциал 0В). Q является акцептором электронов в фотосистеме II и получает их через Р-680 от донора Z. Как уже отмечалось, восстановительный акцептор Q передает электроны фотосистеме I. Окисленный донор Z является достаточно сильным окислителем, способным окислить воду, что приводит к выделению кислорода. Таким образом, энергия для расщепления воды по- ставляется светом, улавливаемым фотосистемой II. [c.344]
Он получает электроны, передающиеся через эти промежуточные компоненты, от соединения Q (окислительно-восстановительный потенциал 0В). Q является акцептором электронов в фотосистеме II и получает их через Р-680 от донора Z. Как уже отмечалось, восстановительный акцептор Q передает электроны фотосистеме I. Окисленный донор Z является достаточно сильным окислителем, способным окислить воду, что приводит к выделению кислорода. Таким образом, энергия для расщепления воды по- ставляется светом, улавливаемым фотосистемой II. [c.344]
Важным примером делокализации и поглощения энергии является хлорофилл, который обсуждался в послесловии к гл. 20. Ароматическое кольцо, окружающее ион Mg , представляет собой протяженную делокализо-ванную систему, образуемую порфирином (см. рис. 20-19). Электронные энергетические уровни этой системы обусловливают поглощение света с одним максимумом в фиолетовой области, при 430 нм, и вторым максимумом в красной области, при 690 нм (см. рис. 20-22). При поглощении света молекулой хлорофилла ее электрон возбуждается на более высокий уровень это позволяет хлорофиллу восстанавливать ионы Ге » в ферре-доксине, белке с молекулярной массой 13000, который содержит два атома железа, координированные к сере. Последующее окисление ферредоксина служит источником энергии для протекания других реакций, которые в конце концов приводят к расщеплению воды, восстановлению диоксида углерода и, наконец, к синтезу глюкозы, С НиОв. [c.307]
20-22). При поглощении света молекулой хлорофилла ее электрон возбуждается на более высокий уровень это позволяет хлорофиллу восстанавливать ионы Ге » в ферре-доксине, белке с молекулярной массой 13000, который содержит два атома железа, координированные к сере. Последующее окисление ферредоксина служит источником энергии для протекания других реакций, которые в конце концов приводят к расщеплению воды, восстановлению диоксида углерода и, наконец, к синтезу глюкозы, С НиОв. [c.307]
Побочной стадией гликолитического и спиртового брожения является так называемый пентозофосфатный путь, на котором происходит расщепление воды и также выделение СОа. [c.53]
Модификацию цеолита мохсно проводить посредством ионного обмена. Общий способ приготовления цеолитов, обладающих каталитической активностью, заключается в обмене ионов Na на двух- или трехвалентные катионы и нагревании полученного материала до температуры >300 °С. Такой метод позволяет ввести в цеолиты все ионы периодической системы элементов Д. И.Менделеева. Поливалентные катионные формы цеолитов образуют центры, идентичные тем, которые имеются в Н-цеолитах. Полагают, что образование подобных кислотных центров происходит благодаря расщеплению воды, связан- [c.109]
И.Менделеева. Поливалентные катионные формы цеолитов образуют центры, идентичные тем, которые имеются в Н-цеолитах. Полагают, что образование подобных кислотных центров происходит благодаря расщеплению воды, связан- [c.109]
Реактор, в котором проводят расщепление воды, имеет вид кожухотрубчатого диффузора, изготовленного из палладиевых трубок, через которые может диффундировать только водород, но не кислород или вода. Реактор помещают между полюсами магнита. Пары воды при относительно высоких температуре и давлении поступают в реактор из испарителя. Водород отводится через стенки, неразложившаяся вода, кислород и остаток водорода удаляют через конец трубки. В случае необходимости использования катализатора им можно набить трубку. [c.335]
Давно известен термохимический цикл расщепления воды, который частично использовался в промышленности [558] под названием железо-паро-углерод-ного процесса. [c.357]
Представляет значительный интерес термохимическое разложете воды, протекавщее при температуре 8 Юf900° .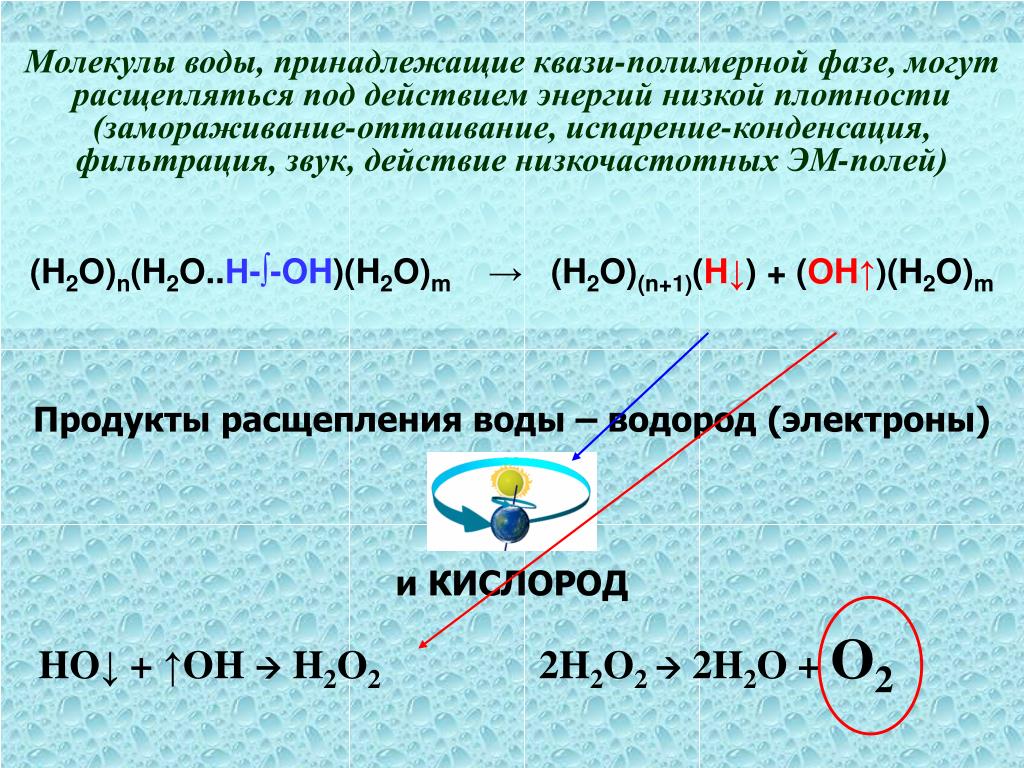 Расщепление воды на водород и кислород осуществляется по сложному циклу с помощью введения в него на определенных стадиях восстановителей или окислителей. Предполагается, что источником тепла для термохимических циклов будет служить атомный реактор /ё/. Термохимические циклы трудно реализуемы из-за протекания побочных реакций. [c.11]
Расщепление воды на водород и кислород осуществляется по сложному циклу с помощью введения в него на определенных стадиях восстановителей или окислителей. Предполагается, что источником тепла для термохимических циклов будет служить атомный реактор /ё/. Термохимические циклы трудно реализуемы из-за протекания побочных реакций. [c.11]
Использование солнечной энергии для расщепления воды на основе комбинирования фотохимических процессов с процессами электролиза я термохимическими процессами является предметом исследований как в Японии, так и в ФРГ. На конференции в Сан-Франциско (США) в 1974 г. [618] докладывался новый метод проведения фотохимических реакций, позволяющий помимо ультрафиолетового излучения использовать также и видимую часть спектра, т. е. преобразовывать в химическую или электрическую энергию большую часть солнечной радиации. В качестве реагирующей системы предложено использовать некоторые красители, в которых фотохимические окислительно-восстановительные реакции протекают относительно быстро. [c.419]
[c.419]
Необходимая для гидролитического расщепления вода появляется в реакционной массе в результате термического разложения солей сульфокислот. [c.146]
Кипящая вода легко расщепляет их с образованием перекиси водорода и альдегида нли кетона или же соответсгвующих последним перекисей или кислот. Эта реакция была использована для определения структуры сложных ненасыщенных органических соединений, например каучука или гуттаперчи, так как по характеру продуктов расщепления можно судить о положении двойной связи в молекуле. Озонирование с успехом применяется также для синтеза труднополучаемых органических соединений. Образование озонидов происходит количественно. Озониды расщепляются также ледяной уксусной кислотой, спиртом или щелочью, причем обычно образуются те же продукты, что и нри расщеплении водой. [c.374]
Взаимодействие частично дегидроксилированной поверхности кремнезема с водой приводит к регидроксилированию поверхности, Регидроксилирование можно рассматривать как процесс расщепления водой связи 51—О в напряженном силоксановом мостике в соответствии со схемой [c. 64]
64]
Сера входит в состав некоторых важнейших аминокислот. Так, в молекуле цистсина содержится группа 8Н. При определенных условиях из двух молекул цистеина образуется ци-стин — в нем остатки цистеина связаны между собой дисуль-фидной связью (8 — 8). Эти связи необходимы для придания белковым молекулам определенной конфигурации. Переход 8—8 8Н осуществляется в процессах переноса водорода в клетках. Этот обратимый процесс служит организму защитой от радиационного поражения улавливаются радикалы Н-и ОН-, появляющиеся в клетках при расщеплении воды под действием радиации. Цистин образуется при гидролизе белков, образующих покровные ткани (из волос, шерсти, рогов и т. д.). [c.182]
Сущностью процесса является использование фотохимической энергии для расщепления воды и тем самым для восстановления СО2. В реакции выделяется молекулярный кислород, хотя он появляется на более ранней стадии последовательности реакций, чем стадия восстановления СО2. Собственно фотохими- [c. 228]
228]
Если Ared И Сох обозначают молекулу воды, то реакция (8.86) будет представлять реакцию расщепления воды [c.280]
Восстановление озонидов сернистой кислотой или амальгамой алюминия дало в общем те же результаты, что расщепление водой. Но при дальнейшем действии у1сазанных реактивов образуются так же соответствующие спирты, что значительно затрудняет количественное определение продуктов распада [c.87]
Так как при восстановлении озонидов образуются те же продукты, что при расщеплении водой, то Штаудингер считает, что предлагае- чая Гарриесом формула оаонида, по которой они являются производными перекиси гликоля, не может удержаться наряду с его формулировкой, рассматривающей озониды как производные ацеталя. По Штаудин гору восстановление озонидов протекает по следующей схеме [c.87]
Модификация цеолитов посредством ионного обмена. Общий способ приготовления цеолитов, обладающих каталитической активностью, заключается в обмене ионов патрия на двух- или трехвалентные катионы и нагревании полученного материала до тем-tieparypbi >300°С.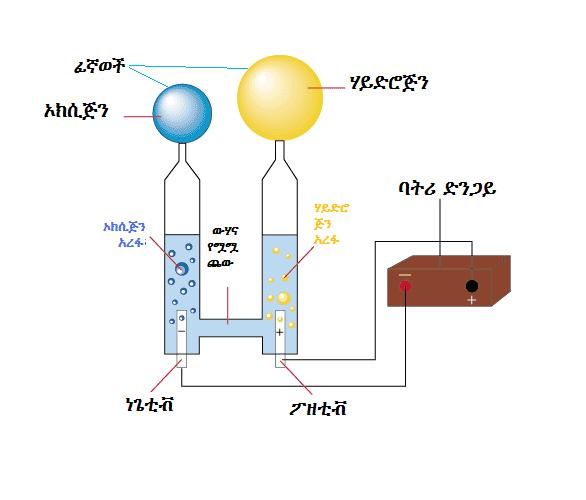 Такой метод позволяет ввести в цеолиты почти все ионы периодической системы [143]. Активность таких замененных цеолитов первоначально объясняли взаимодействием электростатических нолей вблизи катионов с образованием карбокатионов путем поляризации связи С—Н реагирующей молекулы [144]. Эта гипотеза теперь полностью отвергнута, и в настоящее время считают, что поливалентные катионные формы цеолитов образуют кислотные центры, идентичные тем, которые имеются в Н-цеолитах [145]. Полагают, что образование подобных кислотных центров происходит благодаря расщеплению воды, связанной с поливалентными катионами [146] [c.48]
Такой метод позволяет ввести в цеолиты почти все ионы периодической системы [143]. Активность таких замененных цеолитов первоначально объясняли взаимодействием электростатических нолей вблизи катионов с образованием карбокатионов путем поляризации связи С—Н реагирующей молекулы [144]. Эта гипотеза теперь полностью отвергнута, и в настоящее время считают, что поливалентные катионные формы цеолитов образуют кислотные центры, идентичные тем, которые имеются в Н-цеолитах [145]. Полагают, что образование подобных кислотных центров происходит благодаря расщеплению воды, связанной с поливалентными катионами [146] [c.48]
В стадии лабораторных исследований [512] находился и другой метод низкотемпературного расщепления воды с использованием света в термоэлектрической батарее. Такая батарея состоит из трех частей. В первой, верхней части солнечная энергия собирается светопоглощающим материалом (оксид магния или кремния) и тепло стабилизируется на определенном уровне (520 К) расплавом, циркулирующим под светопоглощающей пленкой (металлический калий, натрий). Этот расплав предотвращает внезапные температурные скачки и сохраняет накопленное тепло на стабильном уровне. Вторая часть конструкции представляет полупроводящий сплав с р — -переходом типа висмут — теллур — сурьма, цинк — сурьма — константан. Третьей частью устройства является платиновый элемент, который служит и для [c.340]
Этот расплав предотвращает внезапные температурные скачки и сохраняет накопленное тепло на стабильном уровне. Вторая часть конструкции представляет полупроводящий сплав с р — -переходом типа висмут — теллур — сурьма, цинк — сурьма — константан. Третьей частью устройства является платиновый элемент, который служит и для [c.340]
В последнее время разрабатываются новые направления использования солнечной энергии речь идет о фотосинтетических процессах, сопровождающихся разложением воды и выделением водорода. Вероятно, возможно создание искусственных ламелл с неограниченным временем действия, использующих световую энергию для расщепления воды на водород и кислород. На первой стадии такого типа процессов под действием солнечного света на интенсивной культуре микроводорослей (например, сценедесмусе или хлорелле) начинает накапливаться биомасса и выделяется кислород. На второй стадии биомасса при помощи специальных бактерий перерабатывается в водород или метан. [c. 342]
342]
Опровергнута самая популярная теория строения воды
Учёные СФУ совместно с коллегами из Королевского института технологий Швеции опровергли самую популярную ныне кластерную теорию строения воды. В ходе работы исследователи предложили новую теорию, согласующуюся с результатами их эксперимента. Работа опубликована в журнале Nature Communications. Исследования поддержаны грантом Российского научного фонда.
Вода — одно из самых распространённых, но в то же время необычных веществ на Земле. Она обладает рядом нетипичных свойств, объясняемых её особой структурой, например, высокой теплоёмкостью и низкой электропроводностью. Общепринято, что вода состоит из молекул Н2О, объединённых в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода. Свободные, не входящие в кластеры (группы молекул, связанных водородными связями) молекулы присутствуют лишь в небольшом количестве. Многие учёные считают, что вода — постоянно изменяющаяся смесь кластеров лёгкого и тяжёлого типов. В первом молекулы связаны друг с другом (как во льду), а во втором связи нарушены, благодаря чему такие системы более плотные. Наличие этих фаз можно обнаружить при помощи резонансного неупругого рассеяния рентгеновских фотонов водой. При этом виден переход, в котором электрон с занятой молекулярной орбитали заполняет дырку, на месте которой был выбитый ранее фотоном электрон. Эксперимент с жидкой водой показывает расщепление резонанса на два пика. В научной литературе получившийся дублет приписывается кластерам лёгкого и тяжёлого типов.
Многие учёные считают, что вода — постоянно изменяющаяся смесь кластеров лёгкого и тяжёлого типов. В первом молекулы связаны друг с другом (как во льду), а во втором связи нарушены, благодаря чему такие системы более плотные. Наличие этих фаз можно обнаружить при помощи резонансного неупругого рассеяния рентгеновских фотонов водой. При этом виден переход, в котором электрон с занятой молекулярной орбитали заполняет дырку, на месте которой был выбитый ранее фотоном электрон. Эксперимент с жидкой водой показывает расщепление резонанса на два пика. В научной литературе получившийся дублет приписывается кластерам лёгкого и тяжёлого типов.
Чтобы пролить свет на эту фундаментальную проблему, авторы работы провели эксперимент с парами воды, где нет водородных связей. В ходе исследования они измерили спектр резонансного неупругого рассеяния изолированной молекулы. Эксперименты привели к неожиданному результату и показали, что точно такое же расщепление резонанса на два пика присутствует в рентгеновских спектрах рассеяний молекул воды в газовой фазе. Более того, выполненные теоретические расчёты однозначно объясняют расщепление на спектре сверхбыстрым распадом (диссоциацией) молекулы воды на ионы Н+ и ОН-. Таким образом, исследование свидетельствует о динамической природе расщепления резонанса и опровергает структурный механизм, тем самым демонстрируя, что структура воды однородна.
Более того, выполненные теоретические расчёты однозначно объясняют расщепление на спектре сверхбыстрым распадом (диссоциацией) молекулы воды на ионы Н+ и ОН-. Таким образом, исследование свидетельствует о динамической природе расщепления резонанса и опровергает структурный механизм, тем самым демонстрируя, что структура воды однородна.
Второй не менее важный результат этой работы — получение детальной структурной информации о том, как влияют водородные связи на силу OH-связи. Колебательная инфракрасная (ИК) спектроскопия — общепринятый инструмент для исследования водородных связей в жидкостях. Но в них ИК-спектроскопия показывает лишь наиболее интенсивный переход в состояние с минимальной энергией колебаний, которое «слабо чувствует» межмолекулярное взаимодействие. Спектроскопия резонансного неупругого рассеяния воды качественно отличается от ИК-спектроскопии тем, что, получив энергию от рентгеновского фотона, электрон кислорода переходит с самой глубокой орбитали на первую незанятую. В результате молекула воды быстро диссоциирует. В процессе возбуждённый электрон переходит обратно на самый глубокий уровень, испуская рентгеновский фотон. Частота колебаний испущенного фотона отличается от возбуждающего фотона, так как при этом переходе электрон попадает на уровни с большей энергией. Таким образом, в отличие от ИК-спектра, спектр резонансного неупругого рассеяния состоит из протяжённого набора колебательных пиков. Чем выше колебательное состояние, тем дальше атомы водорода удаляются от кислорода в процессе колебаний связи между О и Н и тем сильнее это колебание чувствует взаимодействие с ближайшей молекулой воды, а именно водородную связь. Резонансное неупругое рассеяние даёт уникальную возможность исследовать водородные связи, в частности определить на основании спектра, как влияют соседние молекулы через водородную связь на потенциал взаимодействия OH-связи.
В результате молекула воды быстро диссоциирует. В процессе возбуждённый электрон переходит обратно на самый глубокий уровень, испуская рентгеновский фотон. Частота колебаний испущенного фотона отличается от возбуждающего фотона, так как при этом переходе электрон попадает на уровни с большей энергией. Таким образом, в отличие от ИК-спектра, спектр резонансного неупругого рассеяния состоит из протяжённого набора колебательных пиков. Чем выше колебательное состояние, тем дальше атомы водорода удаляются от кислорода в процессе колебаний связи между О и Н и тем сильнее это колебание чувствует взаимодействие с ближайшей молекулой воды, а именно водородную связь. Резонансное неупругое рассеяние даёт уникальную возможность исследовать водородные связи, в частности определить на основании спектра, как влияют соседние молекулы через водородную связь на потенциал взаимодействия OH-связи.
«Важно отметить, что, в отличие от изолированной молекулы воды с одной энергией взаимодействия О и Н, в жидкости имеется набор (распределение) таких энергий в силу многообразия ближайшего окружения молекулы воды.— дополняет Фарис Гельмуханов, доктор физико-математических наук, профессор Королевского технологического института (Стокгольм, Швеция), старший научный сотрудник Сибирского федерального университета.Таким образом, второй результат работы — измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с её окружением, а значит, и такие свойства, как скорость звука в воде и её теплоёмкость»,
В работе также приняли участие учёные из Университета Потсдама (Германия), Университета Цюриха (Швейцария) и Университета Турку (Финляндия).
Рисунки
- A) Молекула воды, поглотив фотон, возбуждается из основного состояния (0) в высоковозбуждённое диссоциативное состояние (с), где атом водорода быстро покидает точку равновесия.
 В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.
В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно. - Б) рентгеновский спектр поглощения воды.
- B) Спектры испускания c→f и c→0 вблизи 526 эВ и 535 эВ, соответственно. Эмиссионный спектр c→f вблизи 525 эВ показывает динамическое формирование (в процессе диссоциации) дублета с расщеплением Δ (см. панель A). При возвращении молекулы в основное состояние c→0 в процессе диссоциации заселяются высокие колебательные уровни, что формирует протяжённую колебательную прогрессию в районе 535 эВ.
- Г) В работе решена обратная задача восстановления из колебательной прогрессии распределения OH-потенциалов воды в жидкой фазе.
Пресс-служба РНФ, пресс-служба СФУ,
Опровергнута самая популярная теория строения воды — Газета.Ru
Ученые Сибирского федерального университета совместно с коллегами из Королевского института технологий Швеции опровергли самую популярную ныне кластерную теорию строения воды. В ходе работы исследователи предложили новую теорию, согласующуюся с результатами их эксперимента. Работа опубликована в журнале Nature Communications. Исследования поддержаны грантом Российского научного фонда (РНФ).
В ходе работы исследователи предложили новую теорию, согласующуюся с результатами их эксперимента. Работа опубликована в журнале Nature Communications. Исследования поддержаны грантом Российского научного фонда (РНФ).
Вода обладает рядом нетипичных свойств, объясняемых ее особой структурой, например, высокой теплоемкостью и низкой электропроводностью. Общепринято, что вода состоит из молекул Н2О, объединенных в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода. Свободные, не входящие в кластеры молекулы присутствуют лишь в небольшом количестве. Mногие ученые считают, что вода – постоянно изменяющаяся смесь кластеров легкого и тяжелого типов. В первом молекулы связаны друг с другом (как во льду), а во втором связи нарушены, благодаря чему такие системы более плотные. Наличие этих фаз можно обнаружить при помощи резонансного неупругого рассеяния рентгеновских фотонов водой. При этом виден переход, в котором электрон с занятой молекулярной орбитали заполняет дырку, на месте которой был выбитый ранее фотоном электрон. Эксперимент с жидкой водой показывает расщепление резонанса на два пика. В научной литературе получившийся дублет приписывается кластерам легкого и тяжелого типов.
При этом виден переход, в котором электрон с занятой молекулярной орбитали заполняет дырку, на месте которой был выбитый ранее фотоном электрон. Эксперимент с жидкой водой показывает расщепление резонанса на два пика. В научной литературе получившийся дублет приписывается кластерам легкого и тяжелого типов.
Чтобы пролить свет на эту фундаментальную проблему, авторы работы провели эксперимент с парами воды, где нет водородных связей. В ходе исследования они измерили спектр резонансного неупругого рассеяния изолированной молекулы. Эксперименты показали, что точно такое же расщепление резонанса на два пика присутствует в рентгеновских спектрах рассеяний молекул воды в газовой фазе. Более того, выполненные теоретические расчеты однозначно объясняют расщепление на спектре сверхбыстрым распадом (диссоциацией) молекулы воды на ионы Н+ и ОН-. Таким образом, исследование свидетельствует о динамической природе расщепления резонанса и опровергает структурный механизм, тем самым демонстрируя, что структура воды однородна.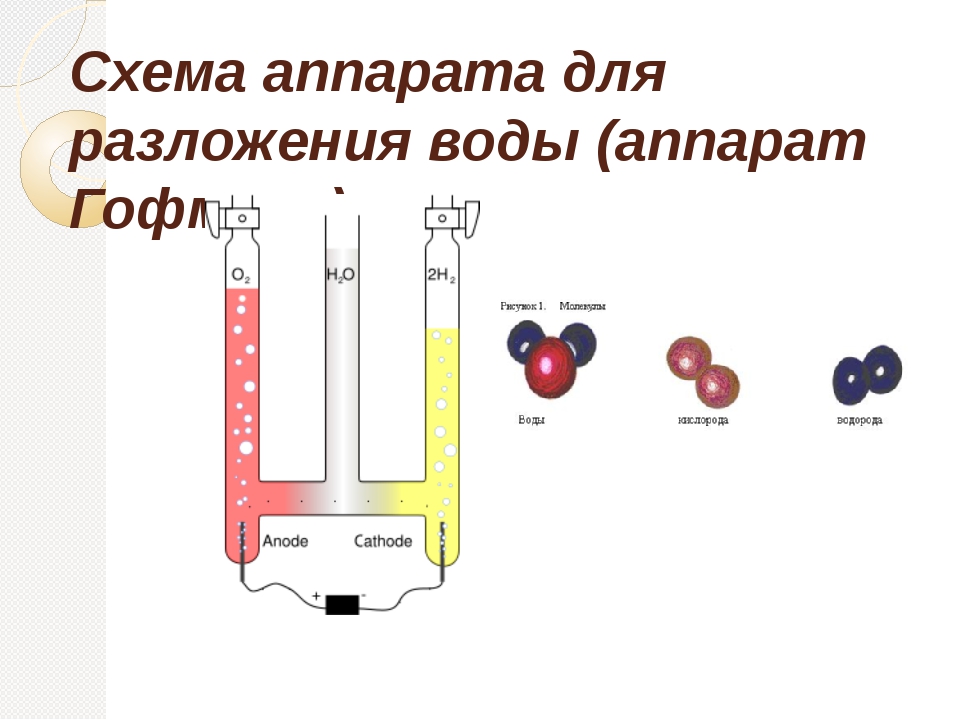
Второй не менее важный результат этой работы – получение детальной структурной информации о том, как влияют водородные связи на силу OH-связи. Колебательная инфракрасная (ИК) спектроскопия – общепринятый инструмент для исследования водородных связей в жидкостях. Но в них ИК-спектроскопия показывает лишь наиболее интенсивный переход в состояние с минимальной энергией колебаний, которое «слабо чувствует» межмолекулярное взаимодействие. Спектроскопия резонансного неупругого рассеяния воды качественно отличается от ИК-спектроскопии тем, что, получив энергию от рентгеновского фотона, электрон кислорода переходит с самой глубокой орбитали на первую незанятую. В результате молекула воды быстро диссоциирует. В процессе возбужденный электрон переходит обратно на самый глубокий уровень, испуская рентгеновский фотон. Частота колебаний испущенного фотона отличается от возбуждающего фотона, так как при этом переходе электрон попадает на уровни с большей энергией. Таким образом, в отличие от ИК-спектра, спектр резонансного неупругого рассеяния состоит из протяженного набора колебательных пиков. Чем выше колебательное состояние, тем дальше атомы водорода удаляются от кислорода в процессе колебаний связи между О и Н и тем сильнее это колебание чувствует взаимодействие с ближайшей молекулой воды, а именно водородную связь. Резонансное неупругое рассеяние дает уникальную возможность исследовать водородные связи, в частности определить на основании спектра, как влияют соседние молекулы через водородную связь на потенциал взаимодействия OH-связи.
Чем выше колебательное состояние, тем дальше атомы водорода удаляются от кислорода в процессе колебаний связи между О и Н и тем сильнее это колебание чувствует взаимодействие с ближайшей молекулой воды, а именно водородную связь. Резонансное неупругое рассеяние дает уникальную возможность исследовать водородные связи, в частности определить на основании спектра, как влияют соседние молекулы через водородную связь на потенциал взаимодействия OH-связи.
«Важно отметить, что, в отличие от изолированной молекулы воды с одной энергией взаимодействия О и Н, в жидкости имеется набор (распределение) таких энергий в силу многообразия ближайшего окружения молекулы воды. Таким образом, второй результат работы – измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследовании? необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы.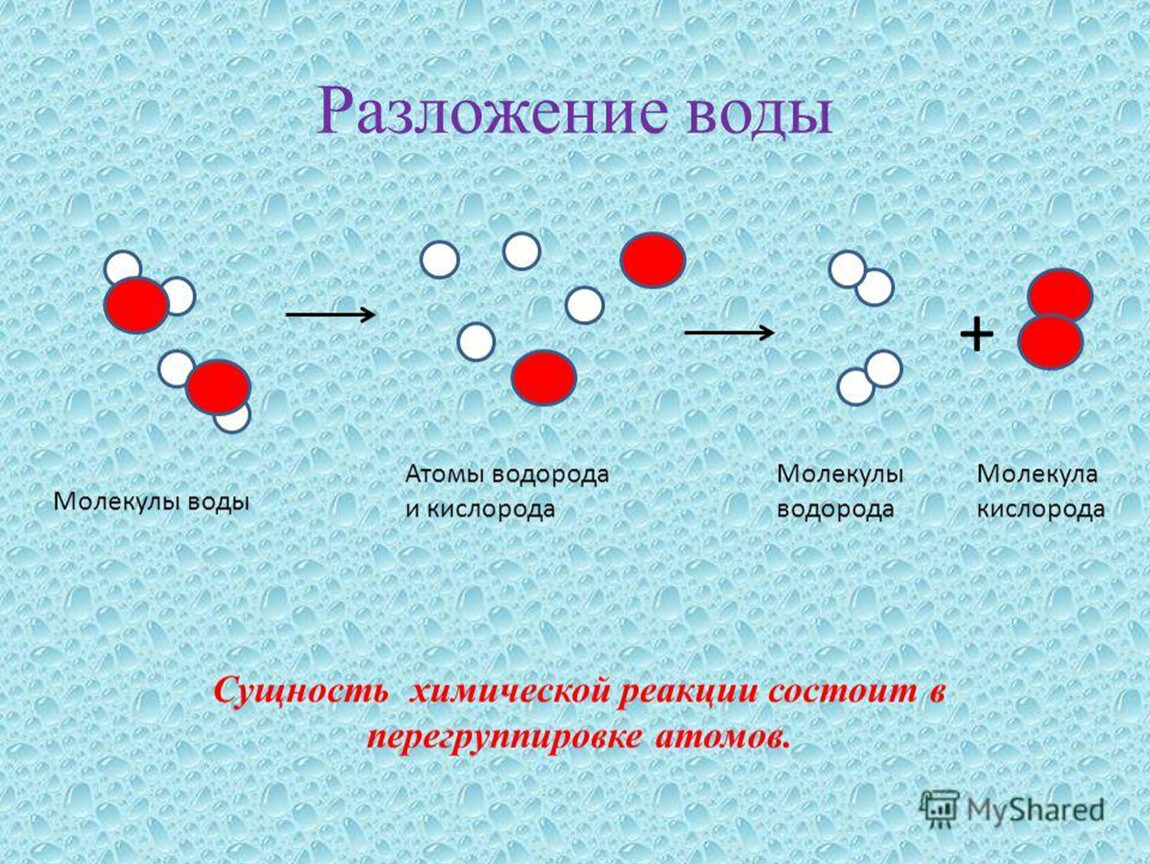 Он определяет энергию взаимодействия последней с ее окружением, а значит, и такие свойства, как скорость звука в воде и ее теплоемкость», – дополняет Фарис Гельмуханов, доктор физико-математических наук, профессор Королевского технологического института (Стокгольм, Швеция), старший научный сотрудник Сибирского федерального университета.
Он определяет энергию взаимодействия последней с ее окружением, а значит, и такие свойства, как скорость звука в воде и ее теплоемкость», – дополняет Фарис Гельмуханов, доктор физико-математических наук, профессор Королевского технологического института (Стокгольм, Швеция), старший научный сотрудник Сибирского федерального университета.
ВОДОРОД ВМЕСТО УГЛЕВОДОРОДОВ | Наука и жизнь
Водород — самое экологически чистое топливо на Земле: при его сгорании образуется только вода. В качестве энергоносителя водород можно использовать для получения электричества и тепла в промышленности, в быту, на транспорте. В частности, с помощью водородных топливных элементов, в которых происходит прямое преобразование химической энергии в электричество, уже созданы опытные образцы электромобилей (см. «Наука и жизнь № 8, 2003 г.). Существует также много способов безопасного хранения и транспортировки водорода. А не нанесут ли вреда природе технологические процессы получения водорода?
В настоящее время водород в промышленных масштабах получают паровой конверсией метана (природного газа). При температуре 750-850оС в присутствии водяного пара метан и вода расщепляются на водород и монооксид углерода, затем при 200-250°С происходит превращение монооксида углерода и воды в водород и диоксид углерода. Оба процесса эндотермические, и для их поддержания приходится сжигать около половины объема исходного газа, из-за чего экологический эффект оказывается очень низким.
При температуре 750-850оС в присутствии водяного пара метан и вода расщепляются на водород и монооксид углерода, затем при 200-250°С происходит превращение монооксида углерода и воды в водород и диоксид углерода. Оба процесса эндотермические, и для их поддержания приходится сжигать около половины объема исходного газа, из-за чего экологический эффект оказывается очень низким.
Предлагается использовать для нагрева и подвода тепла высокотемпературные ядерные реакторы с гелиевым теплоносителем. Таким образом можно экономить углеводородное сырье и поставлять на рынки развивающихся стран водородное топливо вместо ядерных реакторов.
Дальнейшее развитие атомно-водородной энергетики пойдет по пути использования в качестве сырья не метана, а воды. Здесь могут быть использованы электролиз, а также термохимические и комбинированные методы получения водорода.
Известный способ термического разложения воды, которое происходит при температуре 2500°С, вряд ли применим, поскольку сложно предотвратить последующую рекомбинацию молекул воды. Однако возможен термохимический процесс разложения воды при температурах порядка 1000°С в присутствии соединений брома и йода. Правда, здесь требуется подведение тепла, и кпд составляет около 50%. На отдельных стадиях процесса наряду с термическим воздействием используется электролиз.
Однако возможен термохимический процесс разложения воды при температурах порядка 1000°С в присутствии соединений брома и йода. Правда, здесь требуется подведение тепла, и кпд составляет около 50%. На отдельных стадиях процесса наряду с термическим воздействием используется электролиз.
Электролитический водород получить проще всего, но экономически это невыгодно: на получение одного кубометра водорода требуется 4,8 киловатт-часа энергии. Если проводить электролиз перегретого пара, то эффективность процесса повышается, и на получение кубометра водорода уходит около 2,5 киловатт-часа.
В настоящее время «Курчатовский институт» и американская компания «GA» совместно разрабатывают очень перспективный проект газовой турбины-модульного гелиевого реактора. При генерации электричества с использованием прямого газотурбинного цикла можно достичь кпд, равного 50%.
Расщепление воды — Scientific American
Ключевые понятия
Вода
Химия
Электричество
Молекулы
Введение
Пользуешься им каждый день и без него не выживешь — нет, это не интернет, а вода! Это одно из самых важных соединений в мире, и проблема становится все более важной во всем мире. Вы, наверное, слышали, что во многих местах засуха или загрязнение воды ограничивают запасы чистой питьевой воды, и эти запасы продолжают сокращаться.Размышляя об этом, задумывались ли вы когда-нибудь, почему мы не делаем воду сами? Из чего на самом деле состоит вода? В этой научной деятельности вы будете использовать энергию в виде электричества для расщепления воды на отдельные компоненты; так что соберите все материалы и приготовьтесь узнать, что это такое, — и разделите их сами!
Вы, наверное, слышали, что во многих местах засуха или загрязнение воды ограничивают запасы чистой питьевой воды, и эти запасы продолжают сокращаться.Размышляя об этом, задумывались ли вы когда-нибудь, почему мы не делаем воду сами? Из чего на самом деле состоит вода? В этой научной деятельности вы будете использовать энергию в виде электричества для расщепления воды на отдельные компоненты; так что соберите все материалы и приготовьтесь узнать, что это такое, — и разделите их сами!
Фон
Чтобы узнать, из чего состоит вода, полезно посмотреть на ее химическую формулу: h3O. Это в основном говорит нам о том, что молекула воды состоит из двух элементов: водорода и кислорода или, точнее, двух атомов водорода (h3) и одного атома кислорода (O).Водород и кислород являются газами при комнатной температуре. Значит ли это, что мы можем просто соединить оба газа и получить воду? Это не так просто. В уравнении отсутствует энергетическая составляющая химической реакции. Изготовление воды из ее элементов производит большое количество энергии. Химические реакции, в результате которых выделяется энергия, также называют экзотермическими реакциями. В случае водорода и кислорода выделяемая энергия настолько велика, что ее практически невозможно контролировать, и в большинстве случаев она приводит к взрыву.К счастью, эта реакция не происходит самопроизвольно, а происходит только при поджигании газовой смеси зажигалкой.
Изготовление воды из ее элементов производит большое количество энергии. Химические реакции, в результате которых выделяется энергия, также называют экзотермическими реакциями. В случае водорода и кислорода выделяемая энергия настолько велика, что ее практически невозможно контролировать, и в большинстве случаев она приводит к взрыву.К счастью, эта реакция не происходит самопроизвольно, а происходит только при поджигании газовой смеси зажигалкой.
Если делать воду из ее элементов так опасно, то как насчет обратной реакции? Разделить воду на два компонента гораздо проще, и это называется электролизом воды. Получение водорода или кислорода таким способом кажется простым. Но, как вы, вероятно, подозревали, эта обратная реакция требует затрат энергии, поэтому ее также называют эндотермической реакцией. При электролизе воды источником энергии, используемой для протекания реакции, является электричество.Самый простой способ получения электричества — аккумулятор. Однако, поскольку чистая вода плохо проводит электричество, для электролиза требуется добавление электролита , , такого как соль или кислота. Электролит растворяется в воде и разделяется на ионы (электрически заряженные частицы), которые перемещаются в растворах и таким образом могут проводить электричество. Чтобы добавить электричества в раствор, вам также понадобятся два электрических проводника, которые соприкасаются с водой. Они называются электродами и в основном представляют собой металлы или другие проводящие материалы.Когда на электроды подается электрический ток, ионы (электрически заряженные атомы) в электролите, включая положительно заряженные протоны (H + ) и отрицательно заряженные ионы гидроксила (OH — ), которые образуются в результате самоионизации вода — начать движение к электроду с противоположным зарядом, где образуется либо водород, либо кислород. Вы можете убедиться в этом сами в этом упражнении и даже зафиксировать оба газа!
Электролит растворяется в воде и разделяется на ионы (электрически заряженные частицы), которые перемещаются в растворах и таким образом могут проводить электричество. Чтобы добавить электричества в раствор, вам также понадобятся два электрических проводника, которые соприкасаются с водой. Они называются электродами и в основном представляют собой металлы или другие проводящие материалы.Когда на электроды подается электрический ток, ионы (электрически заряженные атомы) в электролите, включая положительно заряженные протоны (H + ) и отрицательно заряженные ионы гидроксила (OH — ), которые образуются в результате самоионизации вода — начать движение к электроду с противоположным зарядом, где образуется либо водород, либо кислород. Вы можете убедиться в этом сами в этом упражнении и даже зафиксировать оба газа!
Материалы
- Водонепроницаемая рабочая зона
- Помощник для взрослых
- Графит для механического карандаша (достаточно толстый, чтобы не сломаться) или деревянный карандаш и нож, чтобы ваш взрослый помощник извлек графит
- Клей
- Play-Doh или другая глина
- Два или три одноразовых пластиковых стаканчика (лучше всего подходят прозрачные пластиковые стаканчики на 18 унций.
 )
) - Ножницы
- Перманентный маркер
- Две металлические кнопки
- Дистиллированная вода
- Пищевая сода
- Аккумулятор на девять вольт
- Две прозрачные соломинки (большой размер)
- Чайная ложка
- Медицинская капельница
- Таймер
- Бумажные полотенца
- Тест-полоски для определения pH (дополнительно)
- Поваренная соль (хлорид натрия — NaCl) (по желанию)
Подготовка
- Ваша рабочая зона должна быть водонепроницаемой; разливы воды могут произойти во время деятельности.
- Соберите свой прочный графитовый механический карандаш. Убедитесь, что у вас есть два куска длиной около 2,5 см (один дюйм). Если вы решите использовать деревянный карандаш, попросите взрослого взять нож и извлечь из карандаша графитовый грифель. (Для этого у вас также должно получиться два куска длиной примерно 2,5 сантиметра). Это будут ваши графитовые электроды.

- Аккуратно отрежьте ножницами (или отрежьте взрослым) открытый конец одного пластикового стаканчика так, чтобы он был на высоте девятивольтовой батареи.В нижней части чашки прорежьте отверстие, чтобы кончик батареи (с двумя полюсами) мог пройти через него.
- Возьмите другую чашку и держите дно этой чашки поверх девятивольтовой батареи. Несмываемым маркером на внутренней стороне чашки нарисуйте две точки внизу, где чашка соприкасается с двумя полюсами батареи.
- Снимите чашку с батареи и с помощью чертежной кнопки проделайте по одному отверстию в каждой отмеченной точке на дне пластиковой чашки.
- Аккуратно вставьте два графитовых (карандашных) штифта в два отверстия, по одному в каждое. Возможно, вам придется сделать отверстия немного больше, чтобы они подходили.
- Используйте клей, чтобы сделать уплотнение вокруг графитовых штифтов на внешней стороне чашки и дайте ему высохнуть. Это должно предотвратить просачивание воды. Убедитесь, что графитовые контакты не все покрыты клеем, иначе они больше не будут контактировать с батареей.

- Поместите вырезанную чашку открытой стороной вниз на батарею.Дно чашки и аккумулятор должны совпадать, образуя ровную поверхность, на которую можно поставить другую чашку.
- Поместите чашку с графитовыми штифтами на перевернутую обрезанную чашку сверху батареи. Он должен сидеть там прочно, и каждый из графитовых штифтов должен касаться одного из полюсов батареи.
- Заклейте один конец обеих соломинок для питья пластилином или пластилином.
Процедура
- Возьмите чашку с графитовыми штифтами и налейте в чашку примерно 300 миллилитров дистиллированной воды подальше от батареи.Убедитесь, что он не протекает. Если это так, вам может понадобиться добавить немного клея, чтобы сделать плотное соединение. Примечание. Не прикасайтесь к воде или электродам после того, как чаша будет помещена на батарею, так как вы можете почувствовать покалывание электричества в пальцах.
- Как и раньше, поместите его на перевернутую обрезанную чашку сверху батареи так, чтобы каждый из графитовых штифтов касался одного из полюсов батареи.
 Возможно, вам придется немного прижать его, чтобы установить хорошее соединение.Обратите внимание на два графитовых электрода. Что ты видишь? Что-то происходит на электродах?
Возможно, вам придется немного прижать его, чтобы установить хорошее соединение.Обратите внимание на два графитовых электрода. Что ты видишь? Что-то происходит на электродах? - Снимите чашу с дистиллированной водой с аккумулятора. Насыпьте одну чайную ложку пищевой соды и размешайте ее в дистиллированной воде, пока все не растворится. Как вы думаете, что изменит пищевая сода? Какую функцию он выполняет?
- Теперь снова поставьте чашку на батарею и соедините графитовые электроды с полюсами батареи. Что ты сейчас наблюдаешь? На графитовых штифтах ничего не происходит? Как вы думаете, что является продуктом реакции? Сравните реакции, происходящие на каждом из графитовых электродов. Вы видите разницу между обеими сторонами? Есть ли один графитовый электрод, на котором реакция выражена сильнее? К какому полюсу батареи подключен этот графитовый штифт, к положительному или отрицательному?
- Засуньте нос в чашку и понюхайте продукты реакции.
 Есть запах? Если да, то как он пахнет?
Есть запах? Если да, то как он пахнет? - Снова снимите чашку с батареи.С помощью пипетки наполните обе закупоренные большие соломинки раствором пищевой соды из чашки с графитовыми штифтами. Когда они наполнятся, закройте каждую одним пальцем и переверните вверх дном. Опустите их в чашку с раствором пищевой соды и осторожно поместите их поверх графитовых штифтов (по одной соломинке на каждую), чтобы соломинки оставались полностью заполненными раствором пищевой соды. Если соломинки не стоят вертикально, вы можете прислонить их к краю чашки. Как вы думаете, что будет с соломинкой?
- После того, как соломинки будут размещены поверх графитовых штифтов, поставьте чашку обратно на батарею. Оставьте его там на 10 минут и немного нажмите на чашку, чтобы убедиться, что электроды остаются подключенными и электродные реакции происходят непрерывно в течение всего этого времени. Обратите внимание на огромные соломинки, которые вы надеваете на графитовые булавки.
 Что происходит с водой, которую вы туда налили? Вы замечаете разницу между двумя уровнями воды в обеих соломинках? Какой из них выше, какой ниже; к каким полюсам батареи подключен каждый из них?
Что происходит с водой, которую вы туда налили? Вы замечаете разницу между двумя уровнями воды в обеих соломинках? Какой из них выше, какой ниже; к каким полюсам батареи подключен каждый из них? - По истечении 10 минут отметьте уровень воды в каждой соломинке несмываемым маркером. Насколько больше воды было вытеснено продуктами реакции на отрицательном полюсе по сравнению с положительным полюсом? Одинаковые, двойные или тройные?
- Дополнительно: Если у вас есть полоски pH, которые могут измерять кислотность или щелочность растворов, используйте их для измерения pH в каждой большой соломинке после того, как уровень воды упадет примерно на 50 процентов. Осторожно снимите большие соломинки с электродов и сразу же запечатайте каждую из них пальцем, как только вы оторвете ее от электродов.Убедитесь, что вы не потеряли воду, которая находится внутри, окуните тест-полоску pH внутрь. Какой цвет показывает тест-полоска и какое значение pH она представляет? Есть ли разница между растворами в двух соломинках? Чем они отличаются и почему, на ваш взгляд, это так?
- Дополнительно: Повторите эксперимент, но вместо пищевой соды в дистиллированную воду добавьте чайную ложку поваренной соли (хлорида натрия или NaCl) и дайте электролизу поработать пять минут.
 Изменяются ли электродные реакции? Что можно сказать о запахе продуктов реакции; Вы можете разобрать определенный запах на этот раз? Как вы думаете, почему это так?
Изменяются ли электродные реакции? Что можно сказать о запахе продуктов реакции; Вы можете разобрать определенный запах на этот раз? Как вы думаете, почему это так? - Дополнительно: Замените графитовые электроды металлическими кнопками. Для этого вам может понадобиться свежая чашка. Вставьте кнопки в дно чашки так, чтобы они не касались друг друга, но так, чтобы каждая из них касалась одного из полюсов батареи, как только вы поместите чашку на батарею. При использовании кнопок клеевое уплотнение не требуется.Повторите исходную процедуру, но на этот раз добавьте в дистиллированную воду одну чайную ложку поваренной соли. Наблюдайте за электродными реакциями. Что происходит на этот раз? Посмотрите внимательно на контакт, который подключен к положительному полюсу аккумулятора. Вы видите другие продукты реакции, кроме газа? Как вы думаете, что произошло? Как выглядят металлические кнопки после того, как вы их снова вытащите?
Наблюдения и результаты
Удалось ли вам разделить воду на водород и кислород? Вы видели много пузырьков на обоих графитовых штифтах? Первоначально, когда вы ставили чашку с дистиллированной водой на аккумулятор, вы, вероятно, не видели, что происходит на графитовых электродах. Это связано с тем, что дистиллированная вода не очень хорошо проводит электричество, поэтому электродные реакции отсутствуют или возможны лишь незначительные реакции. Однако, если вы добавите электролиты, такие как пищевая сода, добавленные ионы могут проводить электричество, и вы должны были увидеть пузырьки газа, появляющиеся на обоих графитовых штифтах. С одной стороны, на положительном полюсе образуется кислород, тогда как на отрицательном полюсе образуется водород.
Это связано с тем, что дистиллированная вода не очень хорошо проводит электричество, поэтому электродные реакции отсутствуют или возможны лишь незначительные реакции. Однако, если вы добавите электролиты, такие как пищевая сода, добавленные ионы могут проводить электричество, и вы должны были увидеть пузырьки газа, появляющиеся на обоих графитовых штифтах. С одной стороны, на положительном полюсе образуется кислород, тогда как на отрицательном полюсе образуется водород.
Присмотревшись, вы могли заметить, что на графитовом электроде, подключенном к отрицательному полюсу батареи, образовалось больше газа, чем на другой стороне.Сбор двух газов с помощью гигантских соломинок, вероятно, продемонстрировал это еще лучше. Через 10 минут уровень воды на отрицательном полюсе должен был быть примерно вдвое меньше, чем на положительном полюсе, а это означает, что вы собрали примерно вдвое больше газообразного водорода по сравнению с кислородом. Разница связана с тем, что на одну молекулу воды приходится два атома водорода на один атом кислорода, как объяснялось выше. Это означает, что для образования одной молекулы кислорода (O2) требуется две молекулы воды (2 ч3О). Однако в то же время из двух молекул воды (2 ч3О) можно получить две молекулы водорода (2 ч3).В то время как на электродах образуются водород и кислород, остаточными продуктами реакции из воды являются протоны (Н + на стороне кислорода) и ионы гидроксила (ОН — на стороне водорода). Вы можете визуализировать это, поместив полоску pH в растворы в больших соломинках над каждым электродом. Раствор в соломинке, помещенной поверх электрода отрицательного полюса батареи, должен иметь щелочной pH (7 или выше), тогда как другой раствор должен быть кислым (pH менее 7).
Это означает, что для образования одной молекулы кислорода (O2) требуется две молекулы воды (2 ч3О). Однако в то же время из двух молекул воды (2 ч3О) можно получить две молекулы водорода (2 ч3).В то время как на электродах образуются водород и кислород, остаточными продуктами реакции из воды являются протоны (Н + на стороне кислорода) и ионы гидроксила (ОН — на стороне водорода). Вы можете визуализировать это, поместив полоску pH в растворы в больших соломинках над каждым электродом. Раствор в соломинке, помещенной поверх электрода отрицательного полюса батареи, должен иметь щелочной pH (7 или выше), тогда как другой раствор должен быть кислым (pH менее 7).
Могут происходить и другие электродные реакции, если в растворе есть ионы, конкурирующие с образованием водорода или кислорода. Возможно, вы заметили, что после того, как вы добавили соль (хлорид натрия) в электролит, он начал пахнуть, как в бассейне. Вместо кислорода на положительном полюсе батареи вырабатывается хлор, который также используется для дезинфекции воды в бассейне. Если вы использовали металлические кнопки в качестве электродов вместо графитовых штифтов, металл (обычно сталь или латунь) будет растворяться или подвергаться коррозии на положительном полюсе батареи, и вместо (или в дополнение) к выделению газа вы должны увидеть, что металлическая кнопка становится красно-коричневой.Это свидетельствует о том, что электролиз — это не только способ расщепления воды на компоненты, но и способ запуска других реакций, которые в противном случае не происходили бы самопроизвольно.
Если вы использовали металлические кнопки в качестве электродов вместо графитовых штифтов, металл (обычно сталь или латунь) будет растворяться или подвергаться коррозии на положительном полюсе батареи, и вместо (или в дополнение) к выделению газа вы должны увидеть, что металлическая кнопка становится красно-коричневой.Это свидетельствует о том, что электролиз — это не только способ расщепления воды на компоненты, но и способ запуска других реакций, которые в противном случае не происходили бы самопроизвольно.
Очистка
Вытрите любые разливы полотенцем. Вылейте воду с электролитом (пищевой содой или солью) в канализацию. Выньте электроды (графитовые штифты или металлические кнопки) из чашек и выбросьте их в мусорное ведро. Выбросьте пластиковые стаканчики и запечатанные большие соломинки в мусорное ведро.Вы можете повторно использовать девятивольтовую батарею.
Дополнительные материалы для изучения
Почему мы не можем производить воду?, из книги How Stuff Works
Химия воды, из книги Джилл Грейнджер
Электролиз воды — водород и кислород из воды, из альтернативного обучения
Топливные элементы — заправляя будущее !, от Science Buddies
Научная деятельность для всех возрастов!, от Science Buddies
Это задание было предложено вам в сотрудничестве с Science Buddies
Расщепление воды | Сделай сам для начинающих
Предупреждение
Этот эксперимент включает электричество и воду. БУДЬТЕ ОСТОРОЖНЫ И НАБЛЮДАЙТЕ ЗА ДЕТЯМИ. Не позволяйте детям прикасаться к воде, когда батарея подключена.
БУДЬТЕ ОСТОРОЖНЫ И НАБЛЮДАЙТЕ ЗА ДЕТЯМИ. Не позволяйте детям прикасаться к воде, когда батарея подключена.
Наконечник
Когда вы подключаете провода, электричество течет по петле от батареи, вниз по одному из карандашей, через воду, затем вверх по другому карандашу и обратно к батарее. Электричество фактически разбивает молекулы воды на части — водород и кислород! Пузырьки, которые вы видите на кончиках карандашей, — это газообразные водород и кислород, образующиеся в результате этой реакции.Фактически, в одном из карандашей создается газообразный водород, а в другом — газообразный кислород. Этот процесс называется электролизом воды. Если вы посмотрите очень внимательно, вы сможете увидеть, что на одном карандаше образуется больше пузырей, чем на другом. Это из-за «2» в названии «h3O». Когда молекула воды распадается, на каждый кислород приходится 2 атома водорода, поэтому вы видите больше пузырьков водорода, чем пузырьков кислорода.
С помощью плоскогубцев снимите металлический ластик с карандашей. Затем заточите оба конца карандашей.
Затем заточите оба конца карандашей.
С помощью канцелярской кнопки проделайте два отверстия рядом с серединой пластиковой крышки прямо напротив друг друга. Расширьте отверстия плоскогубцами, пока карандаш не войдет в них.
Наполните стакан водой примерно наполовину. Добавьте немного пищевой соды и перемешайте. Если вы все еще не видите немного пищевой соды на дне чашки после перемешивания, добавляйте еще пищевой соды, пока не увидите. Затем накройте чашку крышкой.
Совет
Если вы хотите добавить к этому эксперименту, вы можете попробовать его сначала с обычной водой, а затем с пищевой содой.Если вы это сделаете, вы увидите только несколько пузырьков, образующихся в простой воде (или, возможно, их вообще не будет), в то время как добавление пищевой соды в воду приводит к образованию большего количества пузырьков. Это потому, что обычная вода плохо пропускает электричество. Добавление пищевой соды облегчает прохождение электричества. (Другими словами, вода с пищевой содой является лучшим проводником электричества, чем обычная вода.) Чем больше электричества, тем больше молекул воды расщепляется, образуя больше пузырьков!
(Другими словами, вода с пищевой содой является лучшим проводником электричества, чем обычная вода.) Чем больше электричества, тем больше молекул воды расщепляется, образуя больше пузырьков!
Вставьте по одному карандашу в каждое отверстие так, чтобы кончики карандашей были погружены в воду.
Вставьте 9-вольтовую батарею в защелку. Затем подключите свободные провода к выводам, выходящим из защелки аккумулятора.
Наконечник
Подходящие цвета облегчат задачу! Соедините красный провод с красным проводом, а черный провод с черным проводом.
Подсоедините один конец зажимов типа «крокодил» к проводам. Не забывайте сочетать цвета!
Подсоедините другой конец каждого зажима типа «крокодил» к выступающему кончику карандаша.
Что случилось? Можете ли вы сказать, какой карандаш притягивает атомы водорода, а какой атомы кислорода? (Подсказка: на одном карандаше пузырьков больше, чем на другом?)
Расщепляющаяся вода! — Батарея для детейBattery Kids
Электричество «создается», когда определенные химические вещества реагируют друг с другом.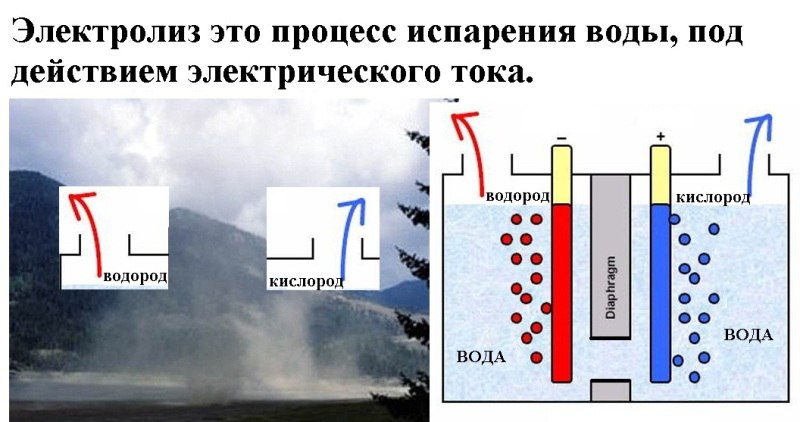 Мы используем химически полученное электричество для питания многих механизмов, от фонариков до часов, а иногда и автомобилей. Да, есть автомобили, которые работают на электричестве! Устройства, накапливающие электричество, называются аккумуляторами.Электричество также можно использовать для химических изменений.
Мы используем химически полученное электричество для питания многих механизмов, от фонариков до часов, а иногда и автомобилей. Да, есть автомобили, которые работают на электричестве! Устройства, накапливающие электричество, называются аккумуляторами.Электричество также можно использовать для химических изменений.
Вода — это простое химическое вещество, состоящее из двух газов — водорода и кислорода. В каждой молекуле воды на каждый атом кислорода приходится два атома водорода. H 2 O это химическая формула молекулы воды.
Если через воду между электродами (положительным и отрицательным полюсами батареи) пропускают электрический ток, вода разделяется на две части: кислород и водород. Этот процесс называется электролизом и широко используется в промышленности, например, при производстве таких металлов, как алюминий.Если один из электродов металлический, он покроется или покроется любым металлом в растворе. Вот как предметы 90 253 посеребряются.
Вы можете использовать электричество для выделения газообразного водорода из воды, аналогично процессу, называемому электролизом.
Что вам нужно:
- Аккумулятор 9 В
- Два обычных карандаша № 2 (удалите ластик и металлическую часть на концах)
- Соль
- Тонкий картон
- Электрический провод
- Маленький стакан
- Вода
Заточите каждый карандаш с обоих концов.
Вырежьте картон, чтобы он подходил к стеклу.
Вставьте два карандаша в картон на расстоянии около дюйма друг от друга.
Растворите около чайной ложки соли в теплой воде и оставьте на некоторое время. Соль помогает лучше проводить электричество в воде.
Используя один отрезок электрического провода, соедините один конец с положительной стороной батареи, а другой — с черным графитом («грифелем» карандаша) в верхней части заточенного карандаша. Сделайте то же самое для отрицательной стороны, соединяющей ее со второй вершиной карандаша.
Поместите два других конца карандаша в соленую воду.
Когда электричество от батареи проходит через электроды (карандаши) и между ними, вода разделяется на водород и хлор газообразный, который собирается в виде очень крошечных пузырьков вокруг каждого кончика карандаша.
Водород скапливается вокруг катода, а газообразный хлор скапливается вокруг анода.
Как можно получить хлор из воды? Хороший вопрос! Иногда в опытах имеет место вторичная реакция.Вот что происходит в этом эксперименте.
Кислород в этом эксперименте не выделяется. Это потому, что атомы кислорода из воды соединяются в жидкости с солью, образуя гидроксильные ионы. Химическая формула соли – NaCl – хлорид натрия. Газообразный хлор образуется из хлорида в соли. Кислород в ионах гидроксила остается в растворе. Итак, в этой реакции выделяется не кислород, а газообразный хлор, который собирается вокруг кончика карандаша. Вокруг другого карандаша находится газообразный водород.
В реальных системах электролиза используется другое решение, и более высокие уровни электричества помогают расщеплять молекулы воды на водород и кислород без этой вторичной реакции.
Расщепление воды – обзор
2 Основной принцип фотоэлектрохимического расщепления воды
Процесс расщепления воды РЕС – это общий термин для химической реакции, в которой вода разделяется на O 2 и H 2 с использованием фотокатализатора, катализирующего воду. реакция расщепления.Принципиальная схема такой общей реакции расщепления воды с использованием полупроводникового фотокатализатора представлена на рис. 8.1.
Рисунок 8.1. Основной принцип общей реакции расщепления воды на полупроводниковом фотокатализаторе. NHE , нормальный водородный электрод.
Общая реакция расщепления воды рассматривается как термодинамически восходящая реакция с большой свободной энергией Гиббса ΔG° = + 237,2 кДж моль -1 (уравнение 8. 1). Это указывает на то, что для преодоления большого положительного изменения свободной энергии Гиббса за счет расщепления воды РЕС требуется энергия фотонов [44].Управляемый светом процесс расщепления воды запускается, когда фотокатализатор TiO 2 n-типа поглощает фотоны ( hv ) с энергиями, превышающими ширину запрещенной зоны. Это поглощение света порождает электроны в зоне проводимости и дырки в валентной зоне (уравнение 8.2). Отверстия выполняют работу на границе электролита TiO 2 , окисляя молекулы воды с образованием ионов O 2 и H + (уравнение 8.3). Электроны будут проходить через внешнюю цепь к платиновому электроду, где они восстанавливают ионы H + , создавая молекулы H 2 , благодаря электрическому полю или внешнему смещению (уравнение8.4).
1). Это указывает на то, что для преодоления большого положительного изменения свободной энергии Гиббса за счет расщепления воды РЕС требуется энергия фотонов [44].Управляемый светом процесс расщепления воды запускается, когда фотокатализатор TiO 2 n-типа поглощает фотоны ( hv ) с энергиями, превышающими ширину запрещенной зоны. Это поглощение света порождает электроны в зоне проводимости и дырки в валентной зоне (уравнение 8.2). Отверстия выполняют работу на границе электролита TiO 2 , окисляя молекулы воды с образованием ионов O 2 и H + (уравнение 8.3). Электроны будут проходить через внешнюю цепь к платиновому электроду, где они восстанавливают ионы H + , создавая молекулы H 2 , благодаря электрическому полю или внешнему смещению (уравнение8.4).
(8.1) 2H 2 O (L) → O 2 (G) + 2H (G) + 2H 2 (G)
(8.2) TIO 2 + 2 HV → Tio 2 + 2 E E — + 2 H + 2 H +
(8. 3) 2H 2 O + 4 H + → O 2 + 4H +
3) 2H 2 O + 4 H + → O 2 + 4H +
(8.4) 2H + 2 e − → H 2
Чтобы эти реакции протекали успешно, ширина запрещенной зоны полупроводникового фотокатализатора должна удовлетворять определенным требованиям.Необходимо, чтобы фотон, доставляющий энергию реакции, имел достаточно энергии для осуществления как реакции окисления, так и реакции восстановления воды на ее поверхности. В случае расщепления воды ФЭК это означает, что поступающая энергия должна быть, по крайней мере, в равновесии с потенциалом ячейки для электролиза воды, который составляет 1,23 эВ при 25°C и 1 атм.
Контакт Шоттки образуется между металлом (фольга Ti) и полупроводником (нанотрубки TiO 2 ). Таким образом, уровень Ферми должен быть постоянным по всему образцу; в противном случае электрический ток не будет течь.Вдоль границы раздела образуется градиент потенциала, который затем приведет к искривлению полосы. Таким образом, фотоиндуцированные электроны заставят перейти из полупроводника в металл. Затем эти фотоиндуцированные электроны будут дрейфовать к противоэлектроду и восстанавливать ионы H + в газы H 2 под внешним смещением.
Таким образом, фотоиндуцированные электроны заставят перейти из полупроводника в металл. Затем эти фотоиндуцированные электроны будут дрейфовать к противоэлектроду и восстанавливать ионы H + в газы H 2 под внешним смещением.
Тем не менее, существуют неизбежные потери энергии, связанные с любым процессом преобразования солнечной энергии с участием полупроводникового фотокатализатора. Когда солнечный свет попадает на фотокатализатор, любое поглощение фотонов с энергией выше ширины запрещенной зоны фотокатализатора будет возбуждать электроны из валентной зоны в зону проводимости.В этом случае рекомбинация электронно-дырочных пар может происходить очень быстро и высвобождать энергию в виде непродуктивного тепла или фотонов [24]. Другими возможными причинами потерь энергии являются транспорт электронов внутри образца при разделении носителей заряда, транспорт электронов от фотоанода к противоэлектроду и джоулев нагрев за счет протекания электронов по внешней цепи [44]. В практической системе разделения воды PEC потери энергии могут превышать 0,8 эВ [65, 66].Таким образом, оптимальная ширина запрещенной зоны полупроводникового фотокатализатора, нанесенного на водорасщепляющую ячейку ПЭК, должна составлять примерно 2,0 эВ [24].
В практической системе разделения воды PEC потери энергии могут превышать 0,8 эВ [65, 66].Таким образом, оптимальная ширина запрещенной зоны полупроводникового фотокатализатора, нанесенного на водорасщепляющую ячейку ПЭК, должна составлять примерно 2,0 эВ [24].
Расщепление молекул воды для будущего возобновляемых источников энергии
Оригинальный пресс-релиз Virginia Tech от Andrew Tie можно прочитать здесь .
Экономика будущего, основанная на возобновляемых и устойчивых источниках энергии, может использовать автомобили с батарейным питанием, крупные солнечные и ветряные электростанции, а также запасы энергии, хранящиеся в батареях и химическом топливе.Хотя уже есть примеры использования устойчивых источников энергии, сроки их повсеместного внедрения определят научные и инженерные прорывы. Одной из предлагаемых парадигм отказа от ископаемого топлива является водородная экономика, в которой водородный газ обеспечивает потребности общества в электроэнергии. Для массового производства газообразного водорода некоторые ученые изучают процесс расщепления воды — двух атомов водорода и одного атома кислорода — в результате чего получится водородное топливо и пригодный для дыхания газообразный кислород.
Для массового производства газообразного водорода некоторые ученые изучают процесс расщепления воды — двух атомов водорода и одного атома кислорода — в результате чего получится водородное топливо и пригодный для дыхания газообразный кислород.
Фэн Линь, доцент кафедры химии Технического колледжа Вирджинии, занимается исследованиями в области накопления и преобразования энергии. Эта текущая работа основана на исследованиях двух источников рентгеновского излучения Министерства энергетики США, включая усовершенствованный источник фотонов (APS) в Аргоннской национальной лаборатории. Это часть нового исследования, опубликованного в качестве обложки в журнале Nature Catalysis , которое устраняет ключевой, фундаментальный барьер в процессе электрохимического расщепления воды, где лаборатория Лин демонстрирует новый метод повторной сборки, оживления и повторного использования катализатора, который обеспечивает энергоэффективное разделение воды.
Основная идея этого исследования восходит к предмету в общих классах химии: катализаторам.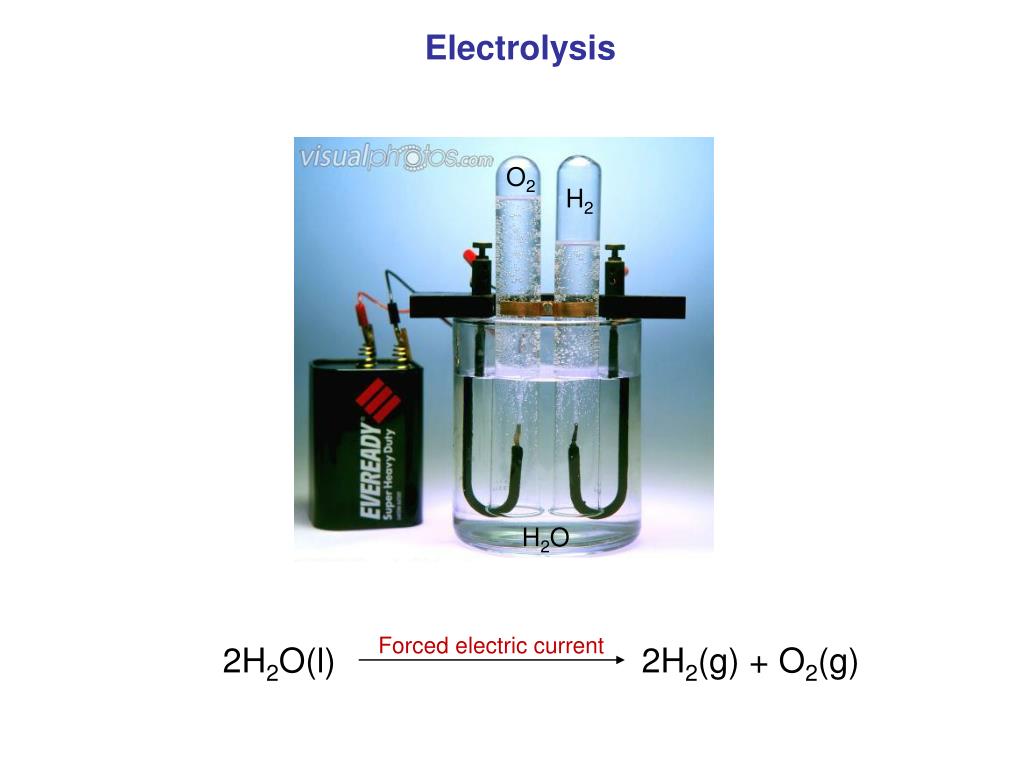 Эти вещества увеличивают скорость реакции, не расходуясь в химическом процессе. Одним из способов, которым катализатор увеличивает скорость реакции, является уменьшение количества энергии, необходимой для начала реакции.
Эти вещества увеличивают скорость реакции, не расходуясь в химическом процессе. Одним из способов, которым катализатор увеличивает скорость реакции, является уменьшение количества энергии, необходимой для начала реакции.
Вода может показаться простой молекулой, состоящей всего из трех атомов, но процесс ее расщепления довольно сложен. Но лаборатория Лин сделала это. Даже перемещение одного электрона от стабильного атома может быть энергоемким, но эта реакция требует переноса четырех электронов для окисления кислорода с образованием газообразного кислорода.
«В электрохимической ячейке процесс переноса четырех электронов сделает реакцию довольно медленной, и нам нужен более высокий электрохимический уровень, чтобы это произошло», — сказал Лин. «С более высокой энергией, необходимой для разделения воды, долгосрочная эффективность и стабильность катализатора становятся ключевыми проблемами».
Чтобы удовлетворить эти высокие потребности в энергии, Lin Lab вводит общий катализатор, называемый смешанным гидроксидом никеля и железа (MNF), чтобы снизить пороговое значение.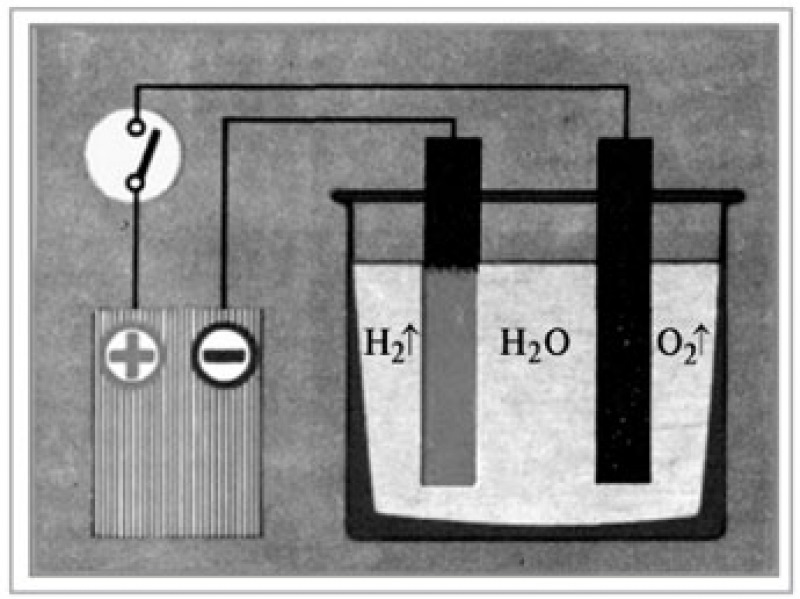 Реакции расщепления воды с МНВ проходят хорошо, но из-за высокой реакционной способности МНВ они имеют короткий срок службы и быстро снижаются каталитические характеристики.
Реакции расщепления воды с МНВ проходят хорошо, но из-за высокой реакционной способности МНВ они имеют короткий срок службы и быстро снижаются каталитические характеристики.
Лин и его команда открыли новую технику, позволяющую периодически собирать МНС в исходное состояние, тем самым позволяя продолжать процесс расщепления воды. (Команда использовала пресную воду в своих экспериментах, но Лин предполагает, что соленая вода — самая распространенная форма воды на Земле — тоже может работать.)
MNF имеет долгую историю исследований в области энергетики. Когда Томас Эдисон возился с батареями более века назад, он также использовал те же элементы из никеля и железа в батареях на основе гидроксида никеля.Эдисон наблюдал образование газообразного кислорода в своих экспериментах с гидроксидом никеля, что плохо для батареи, но в случае расщепления воды целью является производство газообразного кислорода.
«Ученые уже давно поняли, что добавление железа в решетку гидроксида никеля является ключом к повышению реакционной способности расщепления воды». — сказал Куай. «Но в каталитических условиях структура предварительно разработанного МНВ очень динамична из-за высококоррозионной среды электролитического раствора.
— сказал Куай. «Но в каталитических условиях структура предварительно разработанного МНВ очень динамична из-за высококоррозионной среды электролитического раствора.
Во время экспериментов Линя MNF разлагается из твердой формы на ионы металлов в растворе электролита — ключевое ограничение этого процесса. Но команда Линя заметила, что когда электрохимическая ячейка переключается с высокого электрокаталитического потенциала на низкий восстановительный потенциал всего на две минуты, растворенные ионы металлов снова собираются в идеальный катализатор MNF. Это происходит из-за обращения градиента рН на границе между катализатором и раствором электролита.
«Во время действия низкого потенциала в течение двух минут мы продемонстрировали, что не только возвращаем ионы никеля и железа обратно в электрод, но и очень хорошо смешиваем их друг с другом, создавая высокоактивные каталитические центры», — сказал Лин. «Это действительно захватывающе, потому что мы восстанавливаем каталитические материалы в масштабе атомной длины в пределах нескольких нанометров электрохимического интерфейса».
Еще одна причина, по которой преобразование работает так хорошо, заключается в том, что лаборатория Лин синтезировала новый МНВ в виде тонких листов, которые легче собрать, чем объемный материал.
Чтобы подтвердить эти выводы, команда Линя провела синхротронные рентгеновские измерения на усовершенствованном источнике фотонов в Аргонне и на Стэнфордском источнике синхротронного излучения (SSRL) в Национальной ускорительной лаборатории SLAC; оба являются пользовательскими объектами Office of Science. В исследованиях использовалась рентгеновская флуоресцентная микроскопия (XFM, рис. 1) на каналах APS 2-ID-E и 34-ID-E, управляемых группой микроскопии и группой поверхностного рассеяния и микродифракции, соответственно, обе в рентгеновском диапазоне APS. Научный отдел (XSD).Спектроскопию жесткого рентгеновского излучения (XAS) проводили на линии пучка APS 20-ID, управляемой группой XSD-спектроскопии; Данные XAS также были получены на SSRL beamine 4-1.
«Мы хотели наблюдать за тем, что происходило во время всего этого процесса, — сказал Куай. «Мы можем использовать рентгеновское изображение, чтобы буквально увидеть растворение и повторное осаждение этих металлических металлов, чтобы получить фундаментальную картину химических реакций».
«Мы можем использовать рентгеновское изображение, чтобы буквально увидеть растворение и повторное осаждение этих металлических металлов, чтобы получить фундаментальную картину химических реакций».
Синхротронная рентгеновская установка обеспечивает Лину высокие уровни данных в каталитических условиях работы.Исследование также дает представление о ряде других важных наук об электрохимической энергии, таких как восстановление азота, восстановление углекислого газа и воздушно-цинковые батареи.
«Помимо визуализации, многочисленные рентгеновские спектроскопические измерения позволили нам изучить, как отдельные ионы металлов объединяются и образуют кластеры с различным химическим составом», — сказал Лин. «Это действительно открыло двери для исследования электрохимических реакций в реальных химических реакционных средах».
Это открытие не приведет завтра к созданию автомобилей с водородным двигателем, но оно является значительным шагом вперед в фундаментальной науке, ориентированной на приложения, к достижению устойчивого будущего с использованием возобновляемых источников энергии.
See: Chunguang Kuai 1,2 , Zhengrui Xu 1,6 , Cong Xi 2,6 , Anyang Hu 1 , Zhijie Yang 1 , Yan Zhang 2,3 , Cheng-Jun Sun 4 , Luxi Li 4 *, Dimosthenis Sokaras 3 , Cunku Dong 2 , Shi-Zhang Qiao 5 , Xi-Wen Du 2 **, and Feng Lin 1 ***, “Phase segregation reversibility in mixed-metal hydroxide water oxidation catalysts,” Nat.Катал. 4 , 743 (24 августа 2020 г.). DOI: 10.1038/s41929-020-0496-z
Принадлежности авторов: 1 Virginia Tech, 2 Tianjin University, 3 SLAC National Accelerator Laboratory, 4 Argonne National Laboratory, 5 The University of Adelaide
Адрес для переписки: *[email protected], **[email protected], ***[email protected]
Эта работа была поддержана Фондами стартапов химического факультета и Институтом критических технологий и прикладных наук Технологического института Вирджинии. Работа в Тяньцзиньском университете была поддержана Фондом естественных наук Китая (гранты № 51871160, 51671141 и 51471115). Использование Стэнфордского источника синхротронного излучения, Национальной ускорительной лаборатории SLAC, было поддержано Управлением науки и фундаментальных энергетических наук Министерства энергетики США по контракту №. DE-AC02-76SF00515. В этом исследовании использовались ресурсы Advanced Photon Source, пользовательского центра Управления науки Министерства энергетики США, управляемого для Управления науки Министерства энергетики Аргоннской национальной лабораторией по контракту №.DE-AC02-06Ch21357.
Работа в Тяньцзиньском университете была поддержана Фондом естественных наук Китая (гранты № 51871160, 51671141 и 51471115). Использование Стэнфордского источника синхротронного излучения, Национальной ускорительной лаборатории SLAC, было поддержано Управлением науки и фундаментальных энергетических наук Министерства энергетики США по контракту №. DE-AC02-76SF00515. В этом исследовании использовались ресурсы Advanced Photon Source, пользовательского центра Управления науки Министерства энергетики США, управляемого для Управления науки Министерства энергетики Аргоннской национальной лабораторией по контракту №.DE-AC02-06Ch21357.
APS Министерства энергетики США является одним из самых производительных в мире источников рентгеновского излучения. Каждый год APS предоставляет рентгеновские лучи высокой яркости разнообразному сообществу из более чем 5000 исследователей в области материаловедения, химии, физики конденсированных сред, наук о жизни и окружающей среде, а также прикладных исследований. Исследователи, использующие APS, ежегодно выпускают более 2000 публикаций, в которых подробно описываются важные открытия, и решают больше жизненно важных структур биологических белков, чем пользователи любого другого исследовательского центра рентгеновского излучения.Рентгеновские лучи APS идеально подходят для исследования материалов и биологических структур; элементарное распределение; химические, магнитные, электронные состояния; и широкий спектр технологически важных инженерных систем от аккумуляторов до распылителей топливных форсунок, которые являются основой экономического, технологического и физического благополучия нашей страны.
Исследователи, использующие APS, ежегодно выпускают более 2000 публикаций, в которых подробно описываются важные открытия, и решают больше жизненно важных структур биологических белков, чем пользователи любого другого исследовательского центра рентгеновского излучения.Рентгеновские лучи APS идеально подходят для исследования материалов и биологических структур; элементарное распределение; химические, магнитные, электронные состояния; и широкий спектр технологически важных инженерных систем от аккумуляторов до распылителей топливных форсунок, которые являются основой экономического, технологического и физического благополучия нашей страны.
Аргоннская национальная лаборатория ищет решения насущных национальных проблем в области науки и техники. Аргоннская первая в стране национальная лаборатория проводит передовые фундаментальные и прикладные научные исследования практически во всех научных дисциплинах.Исследователи Аргонны тесно сотрудничают с исследователями из сотен компаний, университетов, а также федеральных, государственных и муниципальных учреждений, чтобы помочь им решить их конкретные проблемы, укрепить научное лидерство Америки и подготовить нацию к лучшему будущему. Компания Argonne, в которой работают сотрудники из более чем 60 стран, управляется компанией UChicago Argonne, LLC для Управления науки Министерства энергетики США.
Компания Argonne, в которой работают сотрудники из более чем 60 стран, управляется компанией UChicago Argonne, LLC для Управления науки Министерства энергетики США.
Управление науки Министерства энергетики США является крупнейшим сторонником фундаментальных исследований в области физических наук в Соединенных Штатах и работает над решением некоторых из самых насущных проблем нашего времени.Для получения дополнительной информации посетите веб-сайт Управления науки.
Эксперимент по электролизу воды — расщепление воды
Электролиз — это процесс, при котором электрический ток пропускают через вещество, чтобы вызвать химическое изменение. Химическое изменение происходит, когда вещество теряет электроны (окисление) или приобретает их (восстановление). В двух экспериментах, перечисленных ниже, первым реактивным веществом является вода, а вторым — раствор сульфата меди.
Электролиз используется для удаления волос, расщепления соединений, а также в производственном процессе для украшения, укрепления и повышения устойчивости металлических поверхностей к ржавчине.
>>Посмотрите это видео, чтобы увидеть гальваническое покрытие медного ключа>>
Эксперимент по электролизу воды и эксперимент по гальванике
Электролиз: расщепление водыДля этого эксперимента вы можете собрать свои собственные материалы или купить полный набор для электролиза воды.
Требуется наблюдение взрослых.
Что вам нужно:
Что вы делаете:
1. Наполните химический стакан или стакан теплой водой.
2. Осторожно снимите ластики и металлические гильзы, чтобы можно было заточить оба конца каждого карандаша. Эти карандаши — ваши электроды . Графит в них будет проводить электричество, но не растворится в воде.
3. Отрежьте кусок картона, чтобы надеть стакан, затем проделайте два отверстия в центре картона на расстоянии около дюйма друг от друга. Протолкните карандаши через отверстия и поместите их в стакан. Они должны уходить в воду, но не касаться дна стакана. Картон удержит их на месте.
Картон удержит их на месте.
4. Подсоедините каждый карандаш к батарее с помощью зажима типа «крокодил», прикрепленного к открытому графиту (грифель карандаша). Если у вас нет проводов с зажимом типа «крокодил», используйте два отрезка провода и снимите изоляцию на дюйм с каждого конца. Оберните проволоку вокруг графита каждого карандаша и подключите провода к батарейке. Возможно, вам понадобится скотч, чтобы удерживать провода на месте.
Что произошло:
Как только вы подсоедините провода к аккумулятору, вы увидите пузырьки, которые появляются вокруг каждого кончика карандаша в воде и всплывают вверх.Эти пузырьки представляют собой компоненты воды — газообразные водород и кислород — которые были разделены электричеством, когда оно проходит через воду от одного карандаша к другому. Карандаш, присоединенный к отрицательной клемме батареи, собирает газообразный водород, а карандаш, подключенный к положительной клемме, собирает кислород. Собирает ли один карандаш больше пузырьков, чем другой? Который из? Как вы думаете, почему это так?
(Подсказка: химическое название воды — H 2 O, потому что на каждый атом кислорода в ней приходится два атома водорода.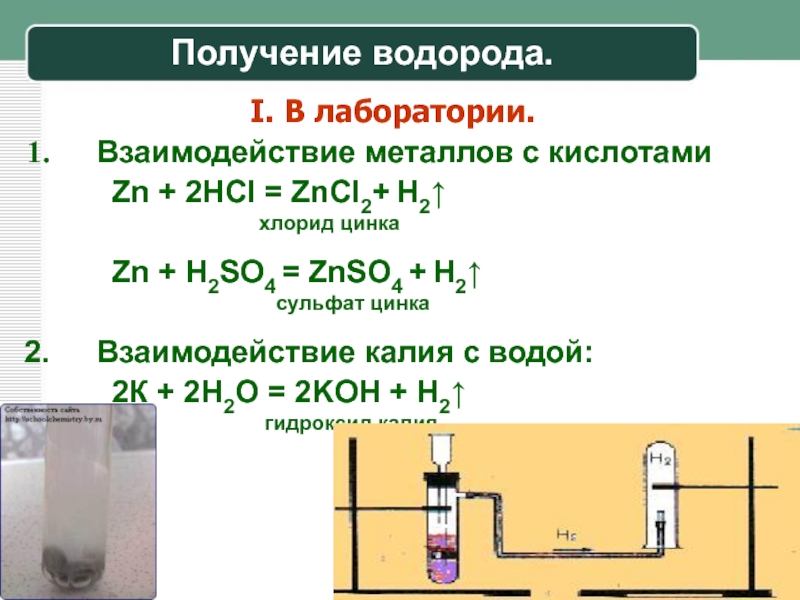 )
)
Дальнейшие эксперименты:
- Попробуйте добавить электролит в воду в стакане. Вода сама по себе не так хорошо проводит электричество, но любой эксперимент по электролизу воды можно ускорить, добавив в воду поваренную соль. Когда это будет сделано, вы должны увидеть изменение скорости образования пузырьков.
Примечание по технике безопасности : при использовании соли может выделяться небольшое количество газообразного хлора, аналогичное количеству, присутствующему при использовании отбеливателя.
- Попробуйте разные типы батарей. Можете ли вы сделать электролиз с помощью 1,5-вольтовой батареи? А если добавить электролит?
- С помощью настоящего электролизного оборудования вы можете собрать два газа в пробирки, чтобы измерить их различное количество и проверить их различную реакцию на пламя.
- Чтобы электролиз работал как настоящая возобновляемая энергия, вам нужно использовать чистый источник энергии для запуска реакции.
 Проведите этот эксперимент по электролизу еще раз, используя солнечные элементы вместо батареи.
Проведите этот эксперимент по электролизу еще раз, используя солнечные элементы вместо батареи.
В гальванике используется форма электролиза, при которой электроды (проводники, обычно металлические) погружают в раствор электролита и держат отдельно друг от друга. Затем, используя в качестве источника питания постоянный ток, один из электродов покрывается металлом другого. Ювелиры и производители посуды используют гальваническое покрытие. Профессиональное гальванопокрытие требует специальных химикатов и оборудования для получения высококачественного покрытия, но в этом эксперименте по электролизу вы можете попробовать свои силы в простой процедуре переноса меди на латунный ключ.
Требуется наблюдение за взрослыми и оборудование для химической безопасности.
>> Посмотрите видео нашего проекта, чтобы увидеть этот проект в действии!
Что вам нужно:
Что вы делаете:
1. Подготовьте ключ к меднению, очистив его зубной пастой или водой с мылом. Высушите его на бумажном полотенце.
Подготовьте ключ к меднению, очистив его зубной пастой или водой с мылом. Высушите его на бумажном полотенце.
2. Размешайте сульфат меди в стакане с небольшим количеством горячей воды, пока он не перестанет растворяться. Ваш раствор должен быть темно-синим. Дать остыть.
3.Используйте один зажим типа «крокодил», чтобы прикрепить медный электрод к положительной клемме батареи (теперь это анод ), а другой — чтобы прикрепить ключ к отрицательной клемме (теперь называемой катодом ).
4. Частично подвесьте ключ в растворе, свободно обернув проволочный стержень вокруг карандаша и поместив карандаш на горловину стакана. Зажим «крокодил» не должен касаться раствора.
5. Поместите медную полоску в раствор, убедившись, что она не касается клавиши, а уровень раствора находится ниже зажима типа «крокодил».Электрическая цепь образовалась, и по ней течет ток.
6. Оставьте схему включенной на 20–30 минут или до тех пор, пока вас не устроит количество меди на ключе.
Что произошло:
Раствор сульфата меди представляет собой электролит, проводящий электричество от одного электрода к другому. Когда протекает ток, на медном аноде происходит окисление (потеря электронов), добавляя ионы меди в раствор. Эти ионы перемещаются с электрическим током к катоду, где происходит восстановление (присоединение электронов), нанося ионы меди на ключ.Ионы меди уже присутствовали в растворе сульфата меди до того, как вы начали, но реакция окисления на аноде продолжала замещать их в растворе по мере того, как они наносились на ключ, поддерживая реакцию.
В этом проекте много переменных, в том числе чистота и гладкость ключа, сила раствора медного купороса и сила тока. Если на ключе начинает образовываться черное копоть, ваш раствор недостаточно силен для тока.Выньте электроды и добавьте еще сульфата меди. Когда вы вставите их обратно, убедитесь, что анод и катод находятся как можно дальше друг от друга.
Есть много проектов, которые вы можете сделать с гальванопокрытием! Одна забавная идея состоит в том, чтобы использовать плоский кусок латуни в качестве катода и нарисовать на нем рисунок маркером на масляной основе.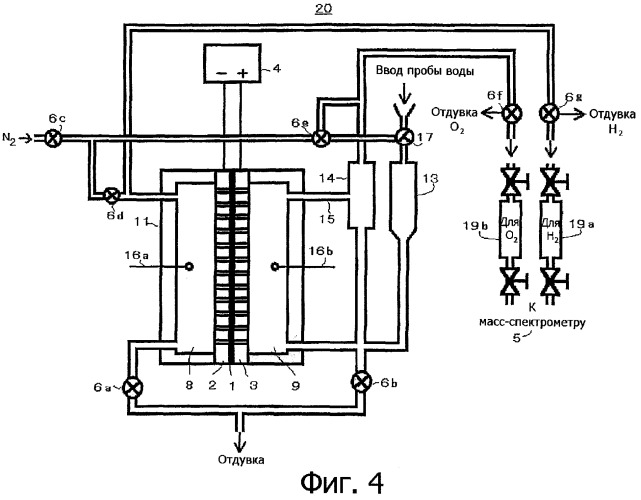 Медь не склеится там, где находится маркер. После того, как вы закончите покрытие, вы можете использовать ацетон (или жидкость для снятия лака), чтобы стереть маркер, оставив рисунок латуни, просвечивающий сквозь медь.Вы можете использовать немного металлического полироля, чтобы сделать медь блестящей, если хотите.
Медь не склеится там, где находится маркер. После того, как вы закончите покрытие, вы можете использовать ацетон (или жидкость для снятия лака), чтобы стереть маркер, оставив рисунок латуни, просвечивающий сквозь медь.Вы можете использовать немного металлического полироля, чтобы сделать медь блестящей, если хотите.
Вы можете попробовать этот простой эксперимент с меднением, который не использует электролиз и требует только бытовых материалов.
Проекты по возобновляемым источникам энергии:Фотокаталитическое расщепление воды: преимущества и проблемы
В последние десятилетия все больший интерес вызывает производство водорода с помощью устройств для расщепления воды, работающих на солнечной энергии, как прямого подхода к созданию экологически чистой и устойчивой энергии.Среди различных альтернатив наиболее простым является прямой фотокаталитический процесс, когда поглотитель света способен производить водород и кислород под действием светового излучения без внешнего смещения.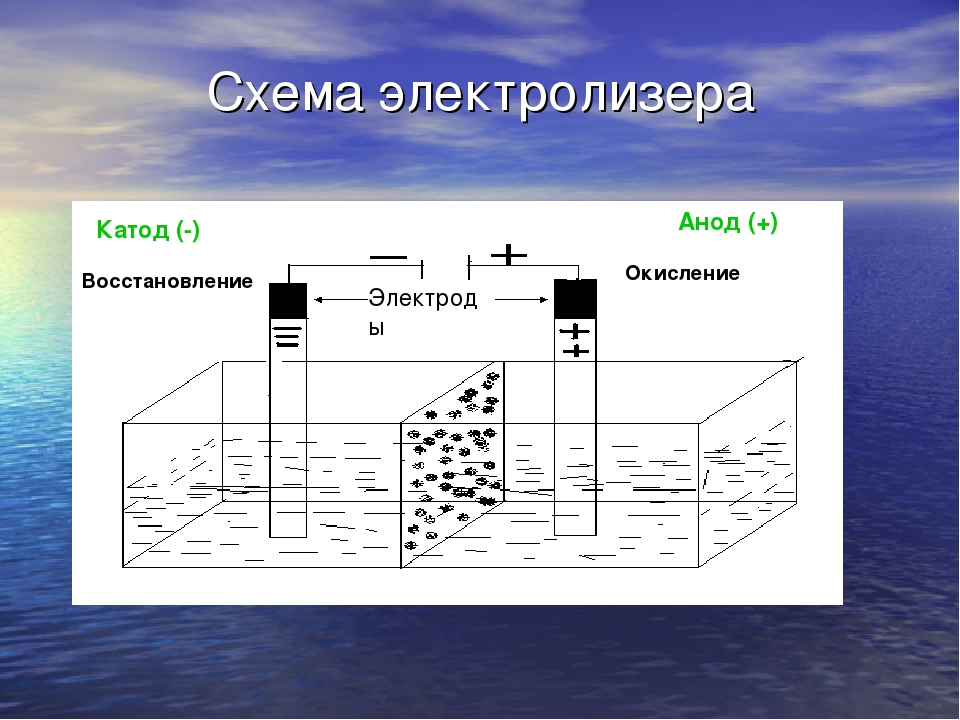 Здесь мы обсуждаем основные плюсы и минусы фотокаталитического расщепления воды для производства водорода, стремясь дать четкое представление о критических проблемах, которые необходимо преодолеть, чтобы эти реакции стали основным игроком в производстве солнечного топлива. Введены основные параметры, ограничивающие выход солнечной энергии в водород и КПД, а также требования к дескрипторам материалов и компонентов.Мы также описываем наиболее перспективные полупроводники и композитные материалы, выделяя их основные характеристики, а также будущие тенденции к улучшению фотокаталитической стабильности, эффективности и кинетики. Таким образом, наша критическая точка зрения перерастает из современного состояния дел в фокус на будущее и жизнеспособность фотокаталитического солнечного водорода.
Здесь мы обсуждаем основные плюсы и минусы фотокаталитического расщепления воды для производства водорода, стремясь дать четкое представление о критических проблемах, которые необходимо преодолеть, чтобы эти реакции стали основным игроком в производстве солнечного топлива. Введены основные параметры, ограничивающие выход солнечной энергии в водород и КПД, а также требования к дескрипторам материалов и компонентов.Мы также описываем наиболее перспективные полупроводники и композитные материалы, выделяя их основные характеристики, а также будущие тенденции к улучшению фотокаталитической стабильности, эффективности и кинетики. Таким образом, наша критическая точка зрения перерастает из современного состояния дел в фокус на будущее и жизнеспособность фотокаталитического солнечного водорода.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент.


 Таким образом, второй результат работы — измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с её окружением, а значит, и такие свойства, как скорость звука в воде и её теплоёмкость»,
Таким образом, второй результат работы — измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с её окружением, а значит, и такие свойства, как скорость звука в воде и её теплоёмкость», В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.
В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно. )
)

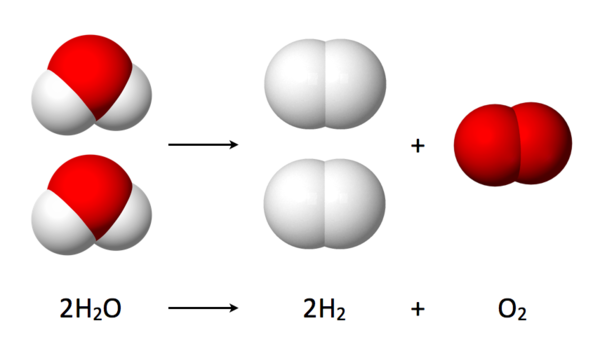 Возможно, вам придется немного прижать его, чтобы установить хорошее соединение.Обратите внимание на два графитовых электрода. Что ты видишь? Что-то происходит на электродах?
Возможно, вам придется немного прижать его, чтобы установить хорошее соединение.Обратите внимание на два графитовых электрода. Что ты видишь? Что-то происходит на электродах?  Есть запах? Если да, то как он пахнет?
Есть запах? Если да, то как он пахнет?  Что происходит с водой, которую вы туда налили? Вы замечаете разницу между двумя уровнями воды в обеих соломинках? Какой из них выше, какой ниже; к каким полюсам батареи подключен каждый из них?
Что происходит с водой, которую вы туда налили? Вы замечаете разницу между двумя уровнями воды в обеих соломинках? Какой из них выше, какой ниже; к каким полюсам батареи подключен каждый из них?  Изменяются ли электродные реакции? Что можно сказать о запахе продуктов реакции; Вы можете разобрать определенный запах на этот раз? Как вы думаете, почему это так?
Изменяются ли электродные реакции? Что можно сказать о запахе продуктов реакции; Вы можете разобрать определенный запах на этот раз? Как вы думаете, почему это так?  Проведите этот эксперимент по электролизу еще раз, используя солнечные элементы вместо батареи.
Проведите этот эксперимент по электролизу еще раз, используя солнечные элементы вместо батареи.