Электролизная – Что такое электролизер, его принцип работы, конструкция и виды
что это такое, применение, сущность, правила, примеры
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.


Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q – заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.


Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:


k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.
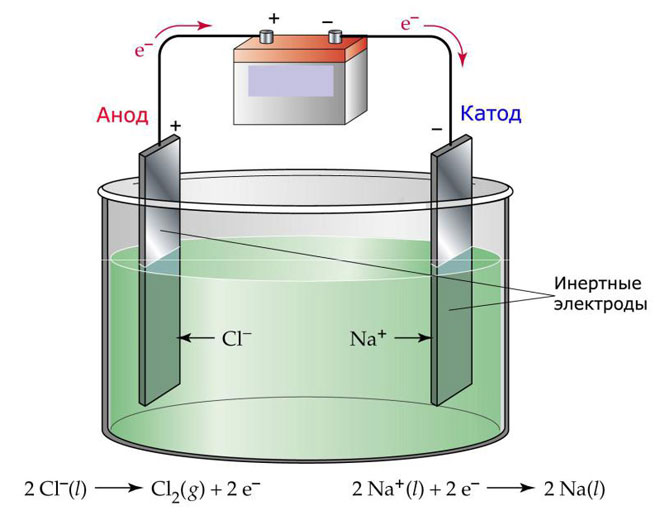

При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.


Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов – Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
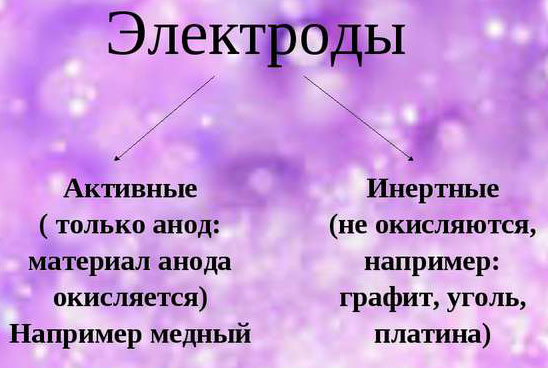

При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.


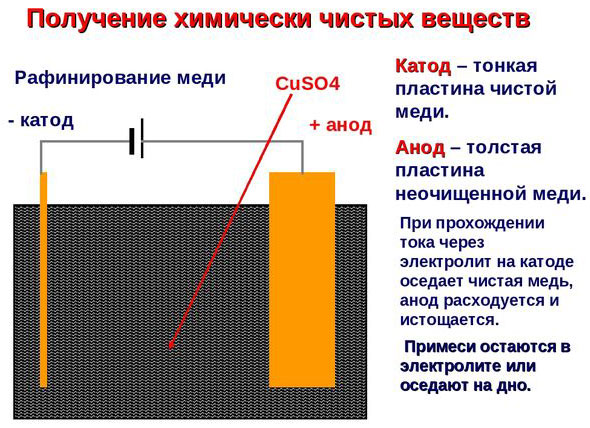
Электроочистка – рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.

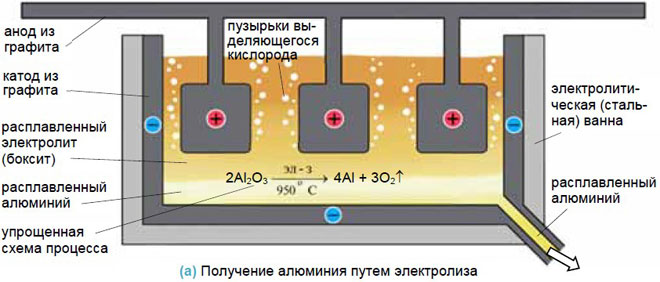
Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.

Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
odinelectric.ru
электролизная — это… Что такое электролизная?
- электролизная
электролизная
(напр. на ТЭС, АЭС)
[А.С.Гольдберг. Англо-русский энергетический словарь. 2006 г.]Тематики
- энергетика в целом
Справочник технического переводчика. – Интент. 2009-2013.
- электролизер с ртутным катодом
- электролизная ванна
Смотреть что такое «электролизная» в других словарях:
электролизная ванна — электролитическая ванна Емкость с электролитом для проведения в ней электролиза, электролитич. рафинирования или гальванотехнич. процесса. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом Синонимы электролитическая ванна EN… … Справочник технического переводчика
Электролизная металлизация
электролизная ванна — Смотри электролизная (электролитическая) ванна … Энциклопедический словарь по металлургии
электролизная (электролитическая) ванна — [electrolyzer] емкость с электролитом для проведения в ней электролиза, электролитического рафинирования или гальванотехнического процесса. Смотри также: Ванна шлаковая ванна сварочная ванна ванна для термической обработки … Энциклопедический словарь по металлургии
электролизная очистка — Syn: электролизное очищение … Металлургический словарь терминов
Блочная электролизная установка — (БЭУ) комплектная установка по получению водорода, состоящая из нескольких электролизеров, сблокированных в один агрегат, и имеющая единую аппаратуру… Источник: Постановление Госгортехнадзора РФ от 06.06.2003 N 75 Об утверждении Правил… … Официальная терминология
Водородная (электролизная) установка — агрегатированная установка, совокупность нескольких аппаратов и устройств на базе электролизера, предназначенная для получения водорода и кислорода, а также отделения их друг от друга, электролита и влаги, для обеспечения систем регуляции… … Официальная терминология
Блочная электролизная установка (БЭУ) — комплектная установка по получению водорода, состоящая из нескольких электролизеров, сблокированных в один агрегат, и имеющая единую аппаратуру. Источник: ПБ 03 598 03: Правила безопасности при производстве водорода методом электролиза воды … Словарь-справочник терминов нормативно-технической документации
ПБ 03-598-03: Правила безопасности при производстве водорода методом электролиза воды — Терминология ПБ 03 598 03: Правила безопасности при производстве водорода методом электролиза воды: «Допускается» данное решение применяется в виде исключения как вынужденное. Определения термина из разных документов: «Допускается» «Как правило»… … Словарь-справочник терминов нормативно-технической документации
technical_translator_dictionary.academic.ru
Электролизер. Виды и типы. Устройство и работа. Применение
Электролизер – это специальное устройство, которое предназначено для разделения компонентов соединения или раствора с помощью электрического тока. Данные приборы широко используются в промышленности, к примеру, для получения активных металлических компонентов из руды, очищения металлов, нанесения на изделия металлических покрытий. Для быта они используются редко, но также встречаются. В частности для домашнего использования предлагаются устройства, которые позволяют определить загрязненность воды или получить так называемую «живую» воду.
Основа работы устройства принцип электролиза, первооткрывателем которого считается известный зарубежный ученый Фарадей. Однако первый электролизер воды за 30 лет до Фарадея создал русский ученый по фамилии Петров. Он на практике доказал, что вода может обогащаться в катодном или анодном состоянии. Несмотря на эту несправедливость, его труды не пропали даром и послужили развитию технологий. На данный момент изобретены и с успехом используются многочисленные виды устройств, которые работают по принципу электролиза.
Что это
Электролизер работает благодаря внешнему источнику питания, который подает электрический ток. Упрощенно агрегат выполнен в виде корпуса, в который вмонтировано два или несколько электродов. Внутри корпуса находится электролит. При подаче электрического тока происходит разложение раствора на требуемые составляющие. Положительно заряженные ионы одного вещества направляются к отрицательно заряженному электроду и наоборот.
Основной характеристикой подобных агрегатов является производительность. То есть это количество раствора или вещества, которое установка может перерабатывать за определенный период времени. Данный параметр указывается в наименовании модели. Однако на него также могут влиять и иные показатели: сила тока, напряжение, вид электролита и так далее.
Виды и типы
По конструкции анода и расположению токопровода электролизер может быть трех видов, это агрегаты с:
- Прессованными обожженными анодами.
- Непрерывным самообжигающимся анодом, а также боковым токопроводом.
- Непрерывным самообжигающимся анодом, а также верхним токопроводом.
Электролизер, используемый для растворов, по конструктивным особенностям можно условно разделить на:
- Сухие.
- Проточные.
- Мембранные.
- Диафрагменные.
Устройство
Конструкции агрегатов могут быть различными, но все они работают на принципе электролиза.
Устройство в большинстве случаев состоит из следующих элементов:
- Электропроводящий корпус.
- Катод.
- Анод.
- Патрубки, предназначенные для ввода электролита, а также вывода веществ, полученных в ходе реакции.
Электроды выполняются герметичными. Обычно они представлены в виде цилиндров, которые сообщаются с внешней средой с помощью патрубков. Электроды изготавливаются из специальных токопроводящих материалов. На катоде осаждается металл или к нему направляют ионы отделенного газа (при расщеплении воды).
В цветной промышленности часто применяют специализированные агрегаты для электролиза. Это более сложные установки, которые имеют свои особенности. Так электролизер для выделения магния и хлора требует ванну, выполненную из стенок торцевого и продольного вида. Она обкладывается с помощью огнеупорных кирпичей и иных материалов, а также делится с помощью перегородки на отделение для электролиза и ячейку, в которой собираются конечные продукты.
Конструктивные особенности каждого вида подобного оборудования позволяют решать лишь конкретные задачи, которые связаны с обеспечением качества выделяющихся веществ, скоростью происходящей реакции, энергоемкостью установки и так далее.
Принцип действия
В электролизных устройствах электрический ток проводят лишь ионные соединения. Поэтому при опускании электродов в электролит и включении электрического тока, в нем начинает течь ионный ток. Положительные частицы в виде катионов направляются к катоду, к примеру, это водород и различные металлы. Анионы, то есть отрицательно заряженные ионы текут к аноду (кислород, хлор).
При подходе к аноду анионы лишаются своего заряда и становятся нейтральными частицами. В результате они оседают на электроде. У катода происходят похожие реакции: катионы забирают у электрода электроны, что приводит к их нейтрализации. В результате катионы оседают на электроде. К примеру, при расщеплении воды образуется водород, которые поднимается наверх в виде пузырьков. Чтобы собрать этот газ над катодом сооружаются специальные патрубки. Через них водород поступает в необходимую емкость, после чего его можно будет использовать по назначению.
Принцип действия в конструкциях разных устройств в целом схож, но в ряде случаев могут быть и свои особенности. Так в мембранных агрегатах используется твердый электролит в виде мембраны, которая имеет полимерную основу. Главная особенность подобных приборов кроется в двойном назначении мембраны. Эта прослойка может переносить протоны и ионы, в том числе разделять электроды и конечные продукты электролиза.
Диафрагменные устройства применяются в случаях, когда нельзя допустить диффузию конечных продуктов электролизного процесса. С этой целью применяют пористую диафрагму, которая выполнена из стекла, асбеста или керамики. В ряде случаев в качестве подобной диафрагмы могут применяться полимерные волокна либо стеклянная вата.
Применение
Электролизер широко применяется в различных отраслях промышленности. Но, несмотря на простую конструкцию, оно имеет различные варианты исполнения и функции. Данное оборудование применяется для:
- Добычи цветных металлов (магний, алюминий).
- Получения химических элементов (разложение воды на кислород и водород, получение хлора).
- Очистки сточных вод (обессоливание, обеззараживание, дезинфекция от ионов металлов).
- Обработки различных продуктов (деминерализация молока, посол мяса, электроактивация пищевых жидкостей, извлечение нитратов и нитритов из овощных продуктов, извлечения белка из водорослей, грибов и рыбных отходов).
В медицине установки используются в интенсивной терапии для детоксикации организма человека, то есть для создания растворов гипохлорита натрия высокой чистоты. Для этого используется устройство проточного вида с электродами из титана.
Электролизные и электродиализные установки нашли широкое применение для решения экологических проблем и опреснения воды. Но эти агрегаты в виду их недостатков используются редко: это сложность конструкции и их эксплуатации, необходимость трехфазного тока и требования периодической замены электродов из-за их растворения.
Подобные установки находят применение и в быту, к примеру, для получения «живой» воды, а также ее очистки. В будущем возможно создание миниатюрных установок, которые будут использоваться в автомобилях для безопасного получения водорода из воды. Водород станет источником энергии, а машину можно будет заправлять обычной водой.
Похожие темы:
electrosam.ru
Электролизные установки
- Главная
- Электролизные установки
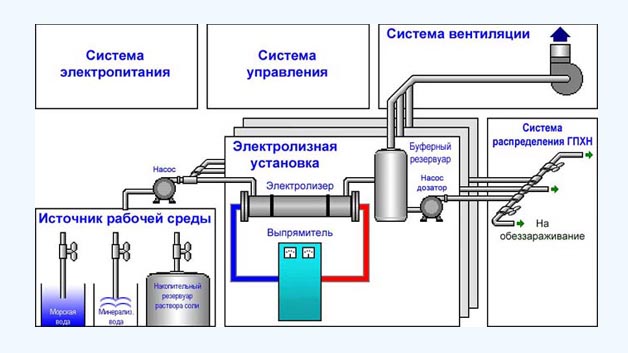

Электролизные установки производительностью:
от 1,0 до 100 кг.а.х./сутки
свыше 100 кг.а.х./сутки
Специалистами ЗАО «НПФ «Юпитер» реализован промышленный способ обработки воды низкоконцентрированным электролитическим гипохлоритом натрия и разработан типовой ряд проточных электролизеров для осуществления этого способа.
Для получения гипохлорита натрия используется, искусственный раствор поваренной соли подземная минерализованная вода с повышенным содержанием хлорида натрия, или морская вода.
Электролиз осуществляется в проточном режиме подачи минерализованной воды через электролизер. На выходе электролизера получаем водный раствор гипохлорита натрия с концентрацией по активному хлору до 8,0 г/л.
Системы и узлы:
1) резервуар мокрого хранения и приготовления насыщенного раствора соли;
2) электролизная установка;
3) система трубопроводов с трубопроводной арматурой;
4) система принудительной вентиляции;
5) система электроснабжения, автоматики и КИП;
6) узел кислотной промывки;
7) установка умягчения воды.
Электролизная установка включает в себя:
1) проточный электролизер;
2) выпрямитель постоянного тока;
3) буферный резервуар;
4) насос для перекачки ГПХН.
Технологический процесс получения водного раствора гипохлорита натрия заключается в следующем: – минерализованная вода насосом по напорному трубопроводу подается в электролизеры. Количество воды, поступающей на электролизеры, устанавливается с помощью задвижек и контролируется счетчиками воды на входах в электролизеры; – Протекающая через электролизеры вода подвергается электролизу. На выходе электролизера образуется раствор гипохлорита натрия
Раствор гипохлорита натрия поступает из электролизеров в буферные резервуары. Из буферных резервуаров раствор насосами подается на обеззараживание, при этом количество активного хлора регулируется производительностью насосов подачи гипохлорита.
Технология и оборудование электролизной при работе на подземной минерализованной воде и при работе на растворе поваренной соли практически аналогичны.
Типовой ряд проточных электролизеров производства ЗАО «НПФ «Юпитер» обеспечивает единичную производительность от 0,05 до 10 кг/ч гипохлорита натрия по активному хлору.
Технология фирмы «ЮПИТЕР» позволяет:
– ликвидировать высокотоксичное хлорное хозяйство;
– обеспечить экологическую и технологическую безопасность на ВОС;
– cнизить концентрацию хлорорганических cоединений в питьевой воде и стоках;
– обеспечить высокую эксплуатационную надежность водоподготовки
– повысить коррозионную стойкость трубопроводов.
Электролизные установки могут использоваться для обеззараживания воды не только на водопроводных станциях, но и в бассейнах, дачных поселках, на теплоэлектростанциях для очистки трубопроводов от биозарастания, в больницах и т.д. – везде, где есть необходимость обеззараживания воды или стоков.
Объем получаемого реагента можно увеличить, разместив на объекте, где осуществляется обеззараживание, необходимое число электролизных установок из предлагаемого типового ряда.
Экологический эффект при отказе от технологии обеззараживания хлором очевиден, а капитальные затраты на внедрение данной технологии, как показывает практика, полностью окупаются в течение двух–пяти лет, в зависимости от мощности установки.
Дополнительно по заказу
Автоматизированная система дозирования гипохлорита натрия по заданному остаточному хлору после первичного и (или) вторичного хлорирования.
jupitersp.ru
электролизная — это… Что такое электролизная?
- электролизная
- electrolysis unit
электролизная
(напр. на ТЭС, АЭС)
[А.С.Гольдберг. Англо-русский энергетический словарь. 2006 г.]Тематики
- энергетика в целом
EN
Русско-английский словарь нормативно-технической терминологии. academic.ru. 2015.
- электролизер с ртутным катодом
- электролизная ванна
Смотреть что такое «электролизная» в других словарях:
электролизная — (напр. на ТЭС, АЭС) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN electrolysis unit … Справочник технического переводчика
электролизная ванна — электролитическая ванна Емкость с электролитом для проведения в ней электролиза, электролитич. рафинирования или гальванотехнич. процесса. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом Синонимы электролитическая ванна EN… … Справочник технического переводчика
Электролизная металлизация — Electroless plating Электролизная металлизация. (1) Процесс, в котором металлические ионы в разбавленном водном растворе осаждаются на детали посредством автокаталитического химического восстановления. (2) Отложение проводящего материала из… … Словарь металлургических терминов
электролизная ванна — Смотри электролизная (электролитическая) ванна … Энциклопедический словарь по металлургии
электролизная (электролитическая) ванна
— [electrolyzer] емкость с электролитом для проведения в ней электролиза, электролитического рафинирования или гальванотехнического процесса. Смотри также: Ванна шлаковая ванна сварочная ванна ванна для термической обработки … Энциклопедический словарь по металлургииэлектролизная очистка — Syn: электролизное очищение … Металлургический словарь терминов
Блочная электролизная установка — (БЭУ) комплектная установка по получению водорода, состоящая из нескольких электролизеров, сблокированных в один агрегат, и имеющая единую аппаратуру… Источник: Постановление Госгортехнадзора РФ от 06.06.2003 N 75 Об утверждении Правил… … Официальная терминология
Водородная (электролизная) установка — агрегатированная установка, совокупность нескольких аппаратов и устройств на базе электролизера, предназначенная для получения водорода и кислорода, а также отделения их друг от друга, электролита и влаги, для обеспечения систем регуляции… … Официальная терминология
Блочная электролизная установка (БЭУ) — комплектная установка по получению водорода, состоящая из нескольких электролизеров, сблокированных в один агрегат, и имеющая единую аппаратуру. Источник: ПБ 03 598 03: Правила безопасности при производстве водорода методом электролиза воды … Словарь-справочник терминов нормативно-технической документации
Водородная (электролизная) установка — агрегатированная установка, совокупность нескольких аппаратов и устройств на базе электролизера, предназначенная для получения водорода и кислорода, а также отделения их друг от друга, электролита и влаги, для обеспечения систем регуляции… … Словарь-справочник терминов нормативно-технической документации
ПБ 03-598-03: Правила безопасности при производстве водорода методом электролиза воды — Терминология ПБ 03 598 03: Правила безопасности при производстве водорода методом электролиза воды: «Допускается» данное решение применяется в виде исключения как вынужденное. Определения термина из разных документов: «Допускается» «Как правило»… … Словарь-справочник терминов нормативно-технической документации
normative_ru_en.academic.ru
Электролизная установка
|
Электролизные установки для получения гипохлорита натрия |
Наши контакты: 8-928-431-63-82 Евгений |
|
Калькулятор цен |
Электролизные установки серии У
Наиболее эффективный способ обеззараживания воды — обеззараживание гипохлоритом натрия. Электролизные установки серии У предназначены для получения гипохлорита натрия из раствора поваренной соли и воды.
Получение гипохлорита натрия непосредственно в месте использования с помощью электролизной установки экономически целесообразно (позволяет значительно снизить расходы на транспортировку гипохлорита натрия) и безопасно (во время длительного хранения гипохлорит натрия разлагается с выделением хлора и кислорода — в электролизных установках это исключено). Получаемый на установках раствор гипохлорита натрия используется в качестве обеззараживающего реагента для обработки бытовых и промышленных сточных вод, обеззараживания питьевой воды на водозаборах, обеззараживания воды в плавательных бассейнах.
Работа установок серии «У»
Установка работает полностью в автоматическом режиме.
Работа электролизной установки построена на электролизе раствора хлорида натрия, при этом протекают следующие реакции:
- На катоде: 2Na++ 2e–→ 2Na; 2Na + 2h3O → 2NaOH +h3↑;
- На аноде: 2Cl–- 2e–→Cl2; Cl2+h3O →HClO +HCl.
- Получающийся в результате реакции гидрооксид натрия (NaOH) взаимодействует с хлорной (HCl) и хлорноватистой кислотами (HClO), образуя соответственно хлорид и гипохлорит натрия. Суммарную реакцию можно записать следующим образом:
- 2NaCl + 3h3O →NaClO + NaCl + 2h3O + h3↑
Полученный раствор поступает в накопительную емкость. Как только накопительная емкость наполнится раствором гипохлорита натрия, работа электролизеров прекращается и установка переходит в режим ожидания. В момент, когда раствор гипохлорита натрия по мере расходования достигнет нижнего уровня накопительной ёмкости, установка снова автоматически включается.
Для контроля технологического процесса получения гипохлорита натрия установка снабжена пультом контроля. Пульт контроля имеет световую индикацию рабочего режима приготовления гипохлорита натрия (зеленый), режима ожидания (зеленый) и световую индикацию отсутствия воды (красный). Блок питания также имеет световую индикацию включения сети электропитания (желтый). При отсутствии воды в подводящем трубопроводе работа установки автоматически прекращается. После устранения неисправностей и возобновления подачи воды установка включается вручную дежурным персоналом.
Техническое обслуживание установки сводится к периодической промывке электролизеров промывочным раствором. Для промывки электродного пакета предусмотрена съемная крышка корпуса электролизера. Периодичность промывки — фактическая.
Мы предлагаем электролизные установки собственного производства, изготовленные по ТУ 3614-001-0157304205-2009
|
Модель |
Максимальная (рабочая) производительность по активному хлору кг/сутки |
Количество модулей |
Общая мощность, кВт |
ДхШхВ, мм |
|
У-2/2 |
4 (2) |
2 по 2 кг/сутки |
2 по 0,8 |
1050х600х2000 |
|
У-2/3,5 |
7 (3,5) |
2 по 3,5 кг/сутки |
2 по 1,1 |
1050х600х2000 |
|
У-2/5 |
10 (5) |
2 по 5 кг/сутки |
2 по 1,5 |
1050х600х2000 |
|
У-3/5 |
15 (10) |
3 по 5 кг/ сутки |
3 по 1,5 |
1050х900х2000 |
|
У-2/10 |
20 (10) |
2 по 10 кг/сутки |
2 по 3,5 |
1050х600х2000 |
|
У-3/10 |
30 (20) |
3 по 10 кг/сутки |
3 по 3,5 |
1050х1000х2000 |
Установки серии «У» предназначены для непрерывного получения раствора гипохлорита натрия путем электролиза водного раствора хлорида натрия (NaCl)
При необходимости, производительность установки может быть увеличена за счет дополнительных модулей, соответственно, стоимость возрастет.
В комплект поставки входит:
- система умягчения воды,
- солерастворитель,
- электролизная установка,
- накопительная емкость, из расчета суточного запаса гипохлорита натрия.
Вопрос поставки дополнительного фильтрующего оборудования и дозирующих устройств для гипохлорита натрия рассматривается отдельно.
Технические характеристики
|
Наименование показателя |
Значение показателя |
|
Рабочее напряжение электропитания установки, В |
220 |
|
Максимальная мощность одного модуля, кВт |
6 |
|
Максимальная производительность одного модуля по активному хлору, кг/сут |
10 |
|
Рабочее напряжение на электролизере, В |
12 |
|
Максимальный ток на электролизере, А |
150 |
|
Концентрация активного хлора в растворе гипохлорита натрия, г/л |
4 — 5 |
|
Удельный расход соли, кг/кг активного хлора |
5,4 |
У наших электролизных установок серии У свои преимущества:
- Есть все разрешительные документы:
- ТУ 3614-001-0157304205-2009;
- сертификат соответствия;
- санитарно-эпидемиологическое заключение;
- патент на полезную модель, т.е ниже описанные преимущества работы заложены только в наши электролизные установки.
- Движение рабочих растворов осуществляется под действием электролизных газов – не требуется установка насосного оборудования
- Минимизированы электрические системы управления, вместо них используются механические
- Узлы, обеспечивающие автоматизацию технологического процесса максимально унифицированы и являются едиными для установок серии «У» различной производительности
- Основные рабочие режимы определяются длинами трубопроводов и объемами технологических емкостей
- Модульное исполнение позволяет по необходимости наращивать производительность
- Присутствует вентиляционная система, не допускающая проникновение электролизных газов в помещение.
Другими словами, преимущество наших электролизных установок в том, что они просты в конструкции, надежны и неприхотливы в работе.
Установки «У-2/2» 2 по 2 и «У-2/5» 2 по 5:
Установки серии «У» производятся в модульном исполнение. Модуль включает в себя электролизер, блок электропитания (выпрямитель) и блок контроля. Общими для всей установки являются: стойка, система приготовления электролита, вентиляционная система, накопительная емкость для сбора приготовленного раствора гипохлорита натрия, солерастворитель (сатуратор).
Схема установки «У-3» без солерастворителя:
Где: 1 — стойка; 2 — электроклапан; 3 — пульт контроля; 4 — емкость для электролита; 5 — вытяжное устройство; 6 — контрольная емкость; 7 — блок питания; 8 – электролизер.
Ответы на часто задаваемые вопросы
- В отличие от хлорирования газообразным хлором, который является очень токсичным, применениеэлектролизных установок не требует организации каких-либо особых условий хранения реагентов, ведь электролизная установка расходует только нетоксичную поваренную соль и электроэнергию.
- При расходе более двух килограмм активного хлора в сутки, выгодней применение гипохлорита натрия, полученного с помощью электролизной установки. Так как свежий гипохлорит натрия «МАРКА А» при хранении быстро разлагается, выделяя хлор и кислород. Согласно ГОСТ 11086-76, его концентрация падает на 30% в течении 10 дней. В тоже время, гипохлорит натрия, полученный электрохимическим методом на месте использования, расходуется в течении непродолжительного времени, поэтому исключается потеря концентрации. Иными словами, эксплуатационные расходы значительно снижены.
- Ещё одним преимуществом применения водно электролизной установки над другими реагентными методами обеззараживания является снижение затрат на транспортировку реагентов, ведь поваренную соль доставлять гораздо проще, чем жидкий раствор гипохлорита натрия и, конечно, ядовитый хлор.
- Подбирать установку лучше с запасом производительности.
- Соль для электролизных установок должна быть класса ЭКСТРА,. В противном случае:
- если в соли содержатся бромиды более 0,01% — это может привести к появлению в питьевой воде броматов (класс опасности 2) в следствии процесса электролиза.
- если в соли содержется жесткость более 0,002% — это приводит к отложению солей на электродах электролитической ячейки, тем самым существенно уменьшается её срок службы.
- Желательно покупать соль, содержащую противослёживающую добавку, например, с ферроцианидом натрия — Е535 или с ферроцианидом калия — Е536. Тут важно отметить, что для электролизной это полезно (но для здоровья людей). На качество гипохлорита данные добавки не влияют.
- В большинстве случаев, перед электролизом необходимо устанавливать оборудование ХВО (химводоочистки), т.е системы умягчения воды, дозации или обратного осмоса — это позволить избежать множество проблем.
h2o-master.ru
Электролиз — это… Что такое Электролиз?
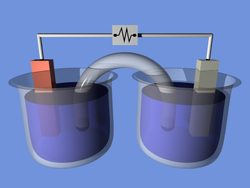
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений[источник не указан 1318 дней], диоксида марганца[2], пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- (1)
- (2)
- (3)
- (4)
- , где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим
где — постоянная Фарадея.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
где — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль; — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; — время, в течение которого проводился электролиз, с; — постоянная Фарадея, Кл·моль−1; — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K»катод»(-): Na+ + 1e = Na0
A»анод»(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2.Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
2) Менее активные металлы
Точно так же
3) Неактивные металлы
Точно так же
Растворы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K»катод»(-): 2H2O + 2e = H2 + 2OH−
A»анод»(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl + 2H2O(электролиз) → H2 + Cl2 +2NaOH
2.Соль активного металла и кислородсодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
Вывод: 2H2O (электролиз) → 2H2 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2H2O (электролиз) → 2H2 + O2
2) Менее активные металлы
1.Соль менее активного металла и бескислородной кислоты
ZnCl2 ↔ Zn2+ + 2Cl−
K»катод»(-): Zn2+ + 2e = Zn0
A»анод»(+): 2Cl− — 2e = 2Cl0
Вывод: ZnCl2 (электролиз) → Zn + Cl2
2.Соль менее активного металла и кислородсодержащей кислоты
ZnSO4 ↔ Zn2++SO42−
K(-): Zn2+ + 2e = Zn0
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2ZnSO4 + 2H2O(электролиз) → 2Zn + 2H2SO4 + O2
3. Гидроксид: невозможно (нерастворим)
3) Неактивные металлы
Точно так же
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
 | В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 11 мая 2011. |
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока, наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей;
1) При отсутствии ионизатора электролиз проводиться не будет даже при высоком напряжении.
2) Электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы.
3) Уравнения электролиза как в электролитах, так и в газах всегда остаются постоянными.
См. также
Примечания
Ссылки
dal.academic.ru

